
Ak sa dlho pohybujete pod vodou, musíte si so sebou vziať kyslík.
TIP
Jednoduchá drevená škvrna
Ak by ste niekedy chceli zafarbiť model z ľahkého dreva na hnedo a nezakryť pritom jeho štruktúru, dobrou voľbou by bol manganistan draselný. Rozpustite jednu malú lyžičku zmesi v skúmavke naplnenej do polovice vodou a model týmto fialovým roztokom natrite. Model bude mať hnedý odtieň.
Zostávajúci roztok: A7
Neustále vdychujete kyslík. Všimli ste si niekedy kyslú chuť počas dýchania? Samozrejme, že nie. Ale slovo kyslík má korene v gréčtine (lat. oxygenium, grécky. oxys : kyslý, gennao rodiť, tvoriť), znamená „ producent kyseliny“. Aký zmysel má tento názov? No je vlastne založený na chybe. Francúzsky chemik Antoine Lavoisier (1743–1797) si myslel, že kyslík je charakteristickou zložkou kyselín, čo, ako viete, nie je pravda. Spoločným znakom kyselín je vodík, nie kyslík. Z úcty k významným úspechom francúzskeho chemika sa však staré meno zachovalo: Francúzsky oxygène, nemecký sauerstoff (= „kyselinový materiál“), anglický oxygen.
V plynnej zmesi vzduchu je kyslík „riedený“ štvornásobkom množstva dusíka. V nasledujúcich experimentoch budete vyrábať o niečo väčšie množstvá nezriedeného kyslíka, aby bolo možné študovať účinok tohto plynu na podporu spaľovania.
Pre chemika, pre ktorého je chémia len koníčkom sú na výrobu kyslíka najlepšie dostupné kyslíkaté zlúčeniny manganistanu draselného a peroxidu vodíka.
Silne sfarbený - manganistan draselný
Manganistan draselný ste už použili na pomalú oxidáciu cukru (Experiment 68). Vaša experimentálna súprava obsahuje zmes manganistanu draselného pozostávajúcu z jedného dielu manganistanu draselného na dva diely síranu sodného.
V prípade manganistanu draselného si prečítajte informácie o nebezpečných látkach a zmesiach na str. 7-9.
Experiment 72
Do Erlenmeyerovej banky umiestnite 1 špičku lyžice zmesi manganistanu draselného a banku naplňte vodou až po značku 100 ml. Banku uzatvorte zátkou a premiešajte trasením. Získate tmavo fialový roztok, ktorého farba bude s pokračujúcim miešaním intenzívnejšia. Na začiatku uvidíte na dne banky nerozpustené kryštály, ktoré uvoľňujú ešte tmavšie oblaky farby .
Napriek tomu, že manganistan draselný môže mať výraznú farbu, je to trochu citlivá zlúčenina.


Experiment 73
Naneste niekoľko kvapiek fialového roztoku z predchádzajúceho pokusu na kúsok papierovej utierky. Fialová farba zmizne a zanechá na papieri žltkasto- hnedé škvrny
V prípade denaturovaného liehu si prečítajte informácie o nebezpečných látkach a zmesiach na str. 7–9. Požiadajte dospelého, aby vám pomohol s manipuláciu s detanurovaným liehom.
Experiment 74
Odmerajte 10 ml fialového roztoku do skúmavky a pridajte 1 ml denaturovaného alkoholu. Vložte varnú tyčinku a zahrejte. Fialová sa postupne zmení na žltohnedú a potom hnedú. Skúmavku umiestnite do stojana na skúmavky, aby sa ochladila. Vzniknú hnedé vločky, ktoré sa zhromažďujú na dne skúmavky. Zrazenina: A6, zostatok roztoku manganistanu draselného: A7
V experimentoch 73 a 74, a aj ako farbivo na drevo, sa manganistan draselný rozkladá a zanecháva oxid manganičitý. Manganistan draselný, ktorý má vzorec KMnO4 , pozostáva z prvkov draslíka - K, mangánu - Mn a kyslíka - O. Pri teplote nad 270 °C sa rozkladá chemickou reakciou:
2KMnO4 → MnO2 + K2MnO4 + O2 a vzniká Oxid Manganičitý MnO2
Tvorba kyslíka
Pri manipulácii so sklenenými skúmavkami buďte opatrní. Poznačte si informácie na str. 15. V prípade zranenia: Prvá pomoc 7 (vo vnútri predného obalu).
Experiment 75
Do suchej skúmavky odmerajte 5 lyžíc zmesi manganistanu draselného a zostavte experimentálne zariadenie znázornené nižšie (alebo na str. 52.) Jedná sa o rovnakú zostavu, ktoré ste použili na výrobu vodíka v experimente 51. Do nádoby s vodou vložte dve skúmavky a majte pripravenú zátku na ich utesnenie (dva otvory zátky utesnite malými sklenenými guľôčkami). Zmes manganistanu draselného zahrejte. Prvé plynové bublinky nechajte uniknúť. Potom zhromaždite plyn do dvoch skúmaviek, jednu po druhej. Po naplnení každej z nich ju pod vodou uzavrite zátkou a umiestnite ju do stojana na skúmavky. Ohriatu skúmavku s jej obsahom si odložte pre Experiment 78.
Stojan na skúmavky so zahriatymi skúmavkami odložte na bok tak, aby sa šikmá trubica už neponárala do vody. V opačnom prípade by mohla studená voda vystúpiť späť do horúcej skúmavky, čo by pravdepodobne spôsobilo jej prasknutie. Teraz môžete plameň horáka uhasiť. .
Kyslík
Kyslík (lat. oxygenium) je chemický prvok v Periodickej tabuľke prvkov, ktorý má značku O a protónové číslo 8. Je to bezfarebný plyn. V kvapalnom a tuhom stave má svetlomodrú farbu. Vo vode je slabo rozpustný. Táto skutočnosť má veľký význam pre život vodných organizmov, pretože im umožňuje dýchanie. Kyslík je veľmi reaktívny prvok. Kyslík je na Zemi najrozšírenejším prvkom. Vo vesmíre je zastúpenie kyslíka podstatne nižšie. Na 1 000 atómov vodíka pripadá iba jeden atóm kyslíka.
Viac informácii nájdete na wikipédii

Kvapalný kyslík sa okrem iného používa na pohon rakiet.


Experiment 76
Doplnkový materiál: čajová sviečka
V plameni sviečky zapáľte drevenú špajľu a následne plameň sfúknite, len aby špajľa tlela. Otvorte prvú z naplnených skúmaviek a položte do nej tlejúcu drevenú špajľu. Bude prskať a znova zapáli. Test tlejúcej špajle slúži ako test prítomnosti kyslíka..
Kyslík prebudí ospalý plameň
V prípade oxidu siričitého si všimnite výstražné a bezpečnostné upozornenia na str. 21.
V prípade manganistanu draselného si prečítajte informácie o nebezpečných látkach a zmesiach na str. 7-9.
Experiment 77
Vykonajte tento experiment vonku alebo v blízkosti otvoreného okna. Po experimente dobre vyvetrajte! Obojstrannú odmernú lyžicu ohnite tak, ako je to zobrazené na ilustrácii vľavo.
Teraz bude slúžiť ako nádoba na spaľovanie síry. Naplňte jej malý koniec sírou. Síru zapáľte v plameni horáka a lyžicu vložte do druhej skúmavky naplnenej kyslíkom . Predtým slabý modrý modrý plameň bude väčší a jasnejší. Síra sa spojila s kyslíkom za vzniku oxidu siričitého, SO2
Čistenie spaľovacej lyžice: Pracujte vonku - uchopte veľký koniec lyžice držiakom na skúmavky a držte malý koniec lyžice nad plameňom horáka dostatočne dlho, aby sa zvyšky síry úplne spálili.
Experiment 78
Dodatočný materiál: Malá sviečka (ako narodeninová sviečka)
Pomocou roztaveného vosku sviečky prilepte 1 cm dlhý kúsok sviečky do menšieho otvoru spaľovacej lyžice, ktorú ste si pripravili v predchádzajúcom experimente. Teraz pridajte do skúmavky z experimentu 75 ďalšie 2 lyžice zmesi manganistanu draselného a použite rovnakú zostavu, akú ste použili na výrobu kyslíka (pozri obrázok vyššie). Naplňte skúmavku kyslíkom, utesnite ju pod vodou zátkou a vložte do stojana na skúmavky. Zapáľte sviečku, otvorte skúmavku a vložte do nej spaľovaciu lyžicu s horiacou sviečkou. Žltý plameň sviečky sa zmení na jasne biely.
Držte spaľovaciu lyžicu v plameni horáka ako v predchádzajúcom experimente, kým nezhoria zvyšky parafínu.
Skúmavku, v ktorej ste zohriali zmes manganistanu draselného, si odložte na nasledujúce experimenty.
Chemické fakty
Všetky procesy spaľovania sú intenzívnejšie v čistom kyslíku ako vo vzduchu, ktorý obsahuje iba jednu pätinu kyslíka.
Mangán, rýchle sa meniaci umelec
Z fialového roztoku manganistanu draselného ste už oddelili hnedý oxid manganičitý. Ale mangán môže mať aj iné farby vo svojich rôznych zlúčeninách.
Experiment 79
Do odparovacej misky naplnenej vodou pridajte 1 malú špičku lyžičky reakčného zvyšku z experimentu 78 . Voda sa okamžite zafarbí na tmavozelenú.
Farba sa čoskoro zmení na fialovú, čo je farba manganistanu draselného. A7
V prípade hydroxidu sodného si prečítajte informácie o „ nebezpečných látkach a zmesiach“ na str. 7-9.
Experiment 80
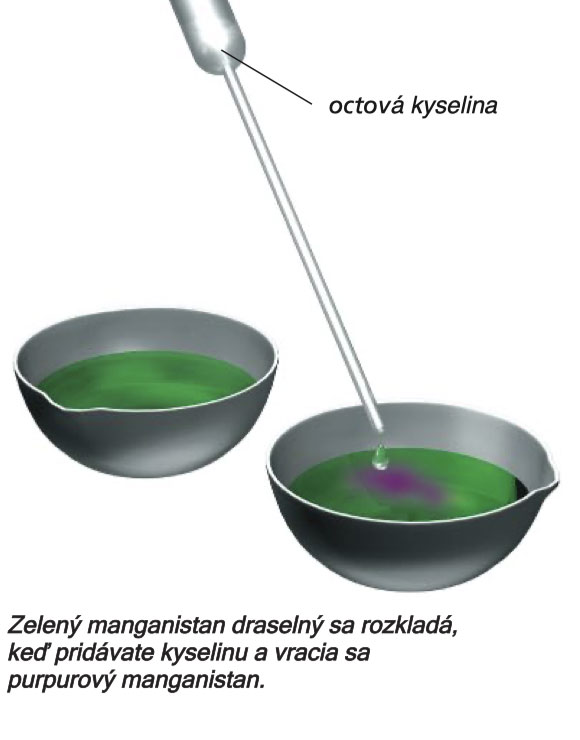
Vyčistenú odparovaciu misku naplňte vodou a pridajte 10 kvapiek hydroxidu sodného. Dobre premiešajte varnou tyčinkou a pridajte 1 malú špičku lyžičky zvyšku z experimentu produkcie kyslíka. Opäť premiešajte. Tentoraz zelená farba pretrvá dlhšie. Ak roztok okyslíte, napríklad octom (5% kyselinou octovou), farba sa zmení na fialovú. A7
Spôsob, akým prebieha chemická reakcia, bude často závisieť od toho, či sa uskutočňuje v kyslom alebo zásaditom roztoku. Pre kyslé reakcie potrebujeme kyseliny, zatiaľ čo zásady alebo bázy potrebujeme pre alkalické (zásadité) reakcie, ako je napríklad roztok lúhu alebo uhličitanu sodného. V kapitole 14 sa dozviete viac o kyselinách a zásadách.
Nestabilný zelený manganistan draselný sa tiež javí len ako prechodná fáza v nasledujúcej „hre farieb“.
Experiment 81
Pripravte silne zriedený, ale stále jasne fialový roztok z jednej malej špičky lyžice zmesi manganistanu draselného. Pridajte niekoľko kvapiek hydroxidu sodného a 1 špičku lyžičky jemného práškového cukru. Skúmavku uzavrite zátkou a premiešajte trasením. Obsah skúmavky sa zmení z modro-fialovej na modrú a zelenú, potom na žltú a nakoniec hnedú. A1
Rovnako ako v experimente 68, išlo tu tiež o pomalé spaľovanie cukru. Kyslík, ktorý je potrebný na tento účel, sa postupne uvoľňoval, čo viedlo k rôznym prechodným fázam. Posledným stupňom je hnedý oxid manganičitý.
Čo je peroxid?
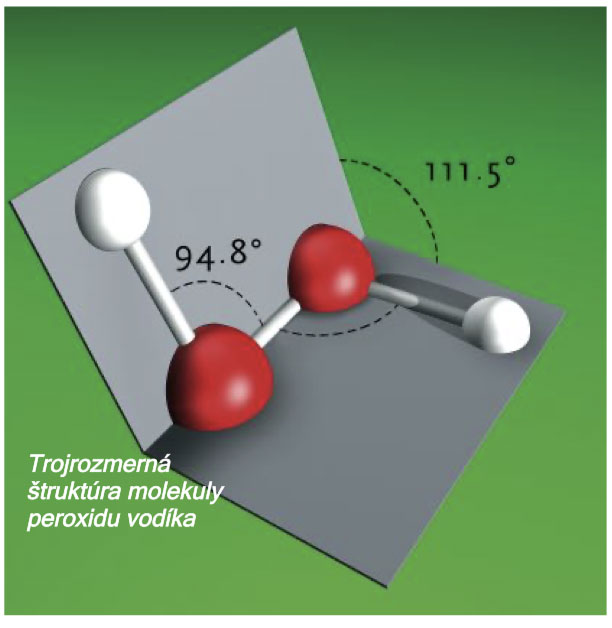
Pri spaľovaní vodíka vzniká voda. Voda je oxidom vodíka a mala by tak byť aj technicky nazývaná. Ale ani chemici ju tak nenazývajú. Peroxid vodíka je na druhej strane bežným pojmom v technických kruhoch a často používanou chemikáliou v laboratóriu. Latinsky "per" znamená „navyše“, „viac“ a týka sa to kyslíka. Peroxid vodíka obsahuje dvakrát viac kyslíka ako voda a jeho vzorec je H202.
Zlúčenina, ktorá sa ľahko rozkladá
Peroxid vodíka sa rozkladá, keď je vystavený teplu, zásadám, zlúčeninám ťažkých kovov a mnohým iným látkam, pričom sa v procese uvoľňuje kyslík:
2 H2O2 → 2 H2O + O2↑
Na nasledujúce experimenty si pripravte niekoľko drevených špajlí.

Od manganistanu draselného po oxid manganičitý.

Peroxid vodíka - dôležité činidlo v laboratóriu
Technológie a životné prostredie
Univerzálny peroxid vodíka
Peroxid vodíka bol prvýkrát vyrobený v roku 1818 chemikom Louis-Jacques Thenardom (1777 - 1857) z peroxidu bárnatého a kyseliny sírovej. Čistý peroxid vodíka je bezfarebná kvapalina, ktorá môže byť zmiešaná s vodou v akomkoľvek pomere a je takmer 1,5 krát ťažšia ako voda: jej hustota pri 20 °C je 1,45 g/cm3 , zatiaľ čo hustota vody je 0,998 g/cm3 . Kuriozitka: Pri zmiešaní s vodou sa roztok stáva viskóznejším (akoby hustejším). Dôvod: sily príťažlivosti medzi molekulami H202 a H2O sú silnejšie ako sily medzi molekulami čistej látky. Sami budete vidieť vo viacerých experimentoch, že peroxid vodíka je nestabilná látka, ktorá sa ľahko rozkladá na vodu a kyslík.
Takže produkt bežne dostupný v obchode (zvyčajne 30% alebo 3% roztok) musíte stabilizovať prostredníctvom prísad, ktoré zabraňujú alebo aspoň spomaľujú proces rozkladu. Peroxid vodíka sa najčastejšie používa ako bieliace činidlo v textilnom, papierenskom a čistiacom priemysle, ako aj v kozmetike a v odfarbovačoch na vlasy. Stále viac sa používa namiesto chlóru na dezinfekciu a dezodorizáciu (zbavenie zápachu) vody na pitie a kúpanie. Peroxid vodíka, hoci je v tele tvorený metabolickými procesmi, je napriek tomu škodlivý a je preto rozkladaný telovými enzýmami (pozri kapitolu 23).
V prípade peroxidu vodíka a uhličitanu sodného si všimnite upozornenia v časti „Nebezpečné látky a zmesi“ na str. 7-9.
Pri manipulácii so sklenenými skúmavkami buďte opatrní. Poznačte si informácie na str. 15. V prípade zranenia: Prvá pomoc 7 (vo vnútri predného obalu).
Experiment 82
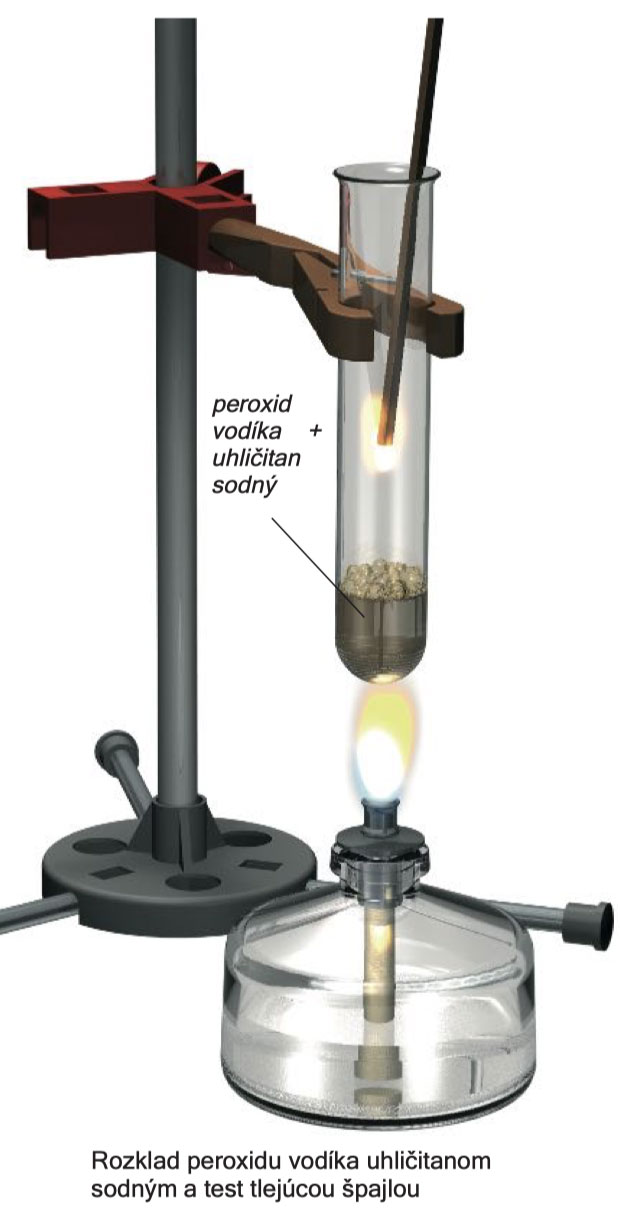
Skúšobnú skúmavku upevnite kolmo do statívu a do skúmavky pridajte 5 ml peroxidu vodíka a 1 lyžicu uhličitanu sodného. Zľahka zahrejte, aby zmes zreagovala. Potom môžete horák odtiahnuť. Preveďte skúšku s tlejúcou špajľou ! A2
Experiment 83
Skúška s tlejúcou špajľou často nemusí fungovať v otvorenej reakčnej nádobe (skúmavke), najmä ak sa v procese ohrevu vytvára príliš veľa vodných pár. V takom prípade upravte predchádzajúci pokus takto: Skúmavku uzavrite zátkou s otvorom a uhlovú skúmavku predĺžte gumovou hadicou. Opäť nechajte uniknúť prvých pár bublín plynu (vzduchu!). Potom zachyťte kyslík v skúmavkách použitím vody ako v experimente 75. Teraz by mala skúška s tlejúcou špajľou fungovať. A2
Aktívne uhlie - aktívne aj ako katalyzátor
Slovo „katalyzátor“ je vám pravdepodobne známe z katalyzátorov používaných v automobiloch. Pre chemika sú katalyzátory zložky, ktoré urýchľujú reakcie. Katalytické konvertory vďačia za svoj názov skutočnosti, že tento druh urýchľovača reakcie sa používa v procese detoxikácie výfukových plynov. Slovo katalyzátor pochádza z gréckeho slova katalyein, preložené ako „rozpustiť“, „zrušiť“, „uvoľniť“. Aby sa reakcia začala, musia sa uvoľniť existujúce väzby. Môže sa to uskutočniť pomocou použitia katalyzátorov. Zaujímavé je, že katalyzátor sa zúčastňuje na reakcii skrytým spôsobom a v reakčnom produkte sa ani neobjavuje.
Chemické fakty
Katalyzátor je materiál, ktorý urýchľuje reakciu bez toho, aby sa prejavil v konečnom produkte.
Experiment 84
Do skúmavky pridajte 2 lyžice aktívneho uhlia a 5 ml peroxidu vodíka. Skúmavku opatrne nakláňajte sem a tam. Začne sa živá produkcia plynu. Po 10–15 sekundách vykonajte skúšku s tlejúcou špajľou, ktorá preukáže prítomnosť kyslíka.
Experiment 85
Po ukončení produkcie plynu kvapalinu opatrne vylejte a do aktívneho uhlia pridajte ďalších 5 ml peroxidu vodíka. Produkcia kyslíka sa opäť spustí (skúška s tlejúcou špajľou). Aktívne uhlie môžete recyklovať (pozri tip na str. 36).
Aktívne uhlie sa nepoužíva počas rozkladu peroxidu vodíka. Jeho katalytický účinok je založený na skutočnosti, že chemické väzby môžu zaniknúť a znovu vzniknúť na jeho veľkej vnútornej ploche.
Ak sa skúška s tlejúcou špajľou neosvedčila v posledných dvoch experimentoch, pridajte niekoľko kvapiek hydroxidu sodného; peroxid vodíka môže obsahovať kyslý stabilizátor.
Rozklad prostredníctvom ťažkých kovov
V prípade hydroxidu sodného , síranu meďnatého , kyseliny chlorovodíkovej a síranu železitého amónneho si všimnite upozornenia v časti „Nebezpečné látky a zmesi“ na str. 7-9.
Experiment 86
Do 5 ml peroxidu vodíka pridajte 10 kvapiek hydroxidu sodného a 1 lyžicu síranu meďnatého. Získate tmavú, šupinatú zrazeninu. Skúšobnú skúmavku jemne hojdajte sem a tam, identifikujte unikajúci plyn (skúška s tlejúcou špajľou) a skúmavku uchovajte pre ďalší experiment..
Experiment 87
Do skúmavky z experimentu 86 pridajte 5 až 6 kvapiek kyseliny chlorovodíkovej. Zrazenina sa rozpustí . Produkcia plynu vo svetlomodrom roztoku sa zastaví. Po pridaní 20 - 25 kvapiek hydroxidu sodného (mierne hojdajte skúmavku) sa produkcia plynu reštartuje a produkuje sa dostatok kyslíka, aby sa drevená tlejúca špajľa opäť vznietila. A6
Experiment 88
Opakujte Experiment 86, ale namiesto síranu meďnatého použite síran amónny železitý. Opäť môžete testovať rozklad peroxidu vodíka vykonaním skúšky s tlejúcou špajľou. A1
V zásaditom roztoku sa hydroxid meďnatý vyrába zo síranu meďnatého a hydroxid železitý (III) sa vyrába zo síranu amónneho železitého (III). Hydroxidy pôsobia ako katalyzátory, ale v kyslom roztoku sú nestabilné, preto sa katalytický účinok zastaví ( experiment 87).
Jodid draselný ako katalyzátor
Experiment 89
Do 5 ml peroxidu vodíka pridajte 1 malú lyžicu jodidu draselného. Obsah skúmavky zmení farbu na svetložltú. Začne sa prudká produkcia plynu.
Skúška s tlejúcou špajľou prebehne bez problémov. A9
V experimentoch 86 až 89 pôsobili rozpustné látky ako katalyzátory. Tieto látky môžu byť zodpovedné za zmeny v priebehu reakcie: zrážanie hydroxidu meďnatého v pokuse 86, tvorba jódu (žltá farba) v experimente 89. V týchto prípadoch je rozhodujúce, že katalyzátor nie je spotrebovaný, ale znovu vytvorený.

Meď v zásaditom roztoku (hydroxid meďnatý) pôsobí ako katalyzátor (vľavo). Prídavok kyseliny rozpustí hydroxid meďnatý a zastaví rozklad peroxidu vodíka (v strede). Po pridaní väčšieho množstva zásad sa hydroxid meďnatý vyzráža a produkcia kyslíka sa reštartuje (vpravo).

Plynový zapaľovač Johanna-Wolfganga Döbereinera (1780–1849). Vo vnútornom valci sa vodík vytvára z kyseliny sírovej a zinkovej cievky (b). Keď je ventil otvorený, plyn prúdi z jemnej dýzy smerom k riedko distribuovanej platine umiestnenej v trubici (f). Platina katalyzuje kombináciu vodíka s atmosférickým dusíkom. Pri tomto procese sa uvoľňuje toľko tepelnej energie, že platina začne žiariť a osvetľuje prúd vodíka. Od: Stöckhardt, Chemická škola (21. vydanie, 1908)

Manganistan draselný a peroxid vodíka
V prípade manganistanu draselného, hydrogén-síranu sodného, uhličitanu sodného a peroxidu vodíka si prečítajte informácie o nebezpečných látkach a zmesiach na str. 7-9..
Experiment 90
1 malú špičku lyžice manganistanu draselného rozpustite v 5 ml vody a pridajte 1 lyžicu hydrogénsíranu sodného. K tmavofialovému roztoku pridajte rovnaký objem peroxidu vodíka. Obsah skúmavky začne vytvárať penu (vykonajte skúšku s tlejúcou špajľou) a po prechode ružovo a hnedo sfarbenými medzifázami sa zmení na číry ako voda.
Experiment 91
Do vodného roztoku z posledného pokusu pridajte 2 až 3 lyžice uhličitanu sodného . Počas penenia roztoku( uvoľňovanie oxidu uhličitého z uhličitanu sodného) sa oddelí hnedá zrazenina, ktorá sa skladá z ťažko rozpustných zlúčenín mangánu.
V pokuse 90 sa z fialového manganistanu draselného vytvorila prakticky bezfarebná zlúčenina, sulfát mangánu (MnSO4 ). Pridaním alkalického kovu alebo uhličitanu sodného sa z číreho roztoku vyzrážal biely hydroxid mangánu, Mn (OH)2 , ktorý sa potom oxidoval kyslíkom zo vzduchu (hnedá farba). Práve ste praktizovali metódu likvidácie (A8).
Zariadenie na výrobu kyslíka
Experiment 92
Pre tento experiment je dobré mať asistenta (dospelého alebo priateľa), pretože budete potrebovať viac ako dve ruky. Pri práci so zahnutými sklenenými trubicami buďte veľmi opatrní.
Zostavte experimentálne zariadenie znázornené na obrázku. Najprv zo špicatej sklenenej skúmavky, gumovej hadice (asi 5 cm dlhej, zvnútra dobre navlhčenej) a sklenenej guličky zostavte hadicový ventil. Ventil upevnite na tryske striekačky (pozri str. 13), ktorá teraz slúži ako kvapkadlový lievik. Do Erlenmeyerovej banky vložte 4 až 5 lyžičiek zmesi manganistanu draselného a 10 ml octu (5% kyseliny octovej). Do kvapkového lievika odmerajte 5 až 10 ml peroxidu vodíka.
Prstami stlačte hadicu v mieste, kde je uložená sklenená gulička (pozri ilustráciu nižšie): Tým otvoríte ventil a peroxid vodíka bude prúdiť do zmesi manganistanu draselného a octu. Začne sa produkcia plynu. Prvé bublinky nechajte uniknúť. Teraz jednou rukou držte prívodnú trubicu a druhou rukou pridržte skúmavku , ktorú budete používať na zachytenie kyslíka.

Ak sa produkcia plynu zastaví, váš pomocník by mal jednou rukou držať tyč statívu a druhou rukou jemne pohybovať Erlenmeyerovou bankou tam a späť. Okrem toho je potrebné hadicový ventil sem-tam otvoriť a nechať prúdiť do banky peroxid vodíka. V prvej naplnenej skúmavke nebude skúška s tlejúcou špajľou veľmi presvedčivá ( intenzívnejšia žiara, ale žiadny plameň). Je to preto, že banka na začiatku experimentu obsahovala veľa atmosférického dusíka. Akonáhle je dusík v priebehu pokusu vytesnený, môžete použiť zariadenie na výrobu kyslíka podľa potreby. A8
