Kyselina chlorovodíková je jednou z najdôležitejších kyselín v laboratóriu a v priemysle. Pomocou tejto kyseliny rozpúšťajú chemici ušľachtilé kovy a iné ťažko rozpustné zlúčeniny. V priemysle sa kyselina chlorovodíková používa na odstraňovanie nežiaducich vrstiev oxidov kovov, remeselníci ju používajú na odstránenie rozstriekanej omietky, ženy v domácnosti ňou likvidovali tvrdohlavé nánosy na toaletách. Dnes existujú menej nebezpečné - aj keď nie úplne neškodné - čistiace prostriedky. Kyselina chlorovodíková zohráva dôležitú úlohu aj pri trávení, pretože sa prirodzene vyskytuje v žalúdočnej šťave.
Niečo o kyseline chlorovodíkovej už viete z predchádzajúcej kapitoly, alebo presnejšie povedané, o jej „aktívnej zložke“, ktorou je plynný chlorovodík. Koncentrovaná, dymiaca kyselina chlorovodíková obsahuje približne 37% chlorovodíka. Avšak kyselina chlorovodíková, ktorú používate, je omnoho slabšia; obsahuje asi 7% chlorovodíka.
Prchavá kyselina
Ako vodný roztok plynu je kyselina chlorovodíková prchavá. Aj pri izbovej teplote, časť chlorovodíka uniká. Ak teplotu zvýšime, vyparovanie chlorovodíka sa zintenzívni.
Všetky pokusy týkajúce sa chlorovodíka vykonajte pri otvorenom okne, najlepšie v jeho blízkosti. Po experimente dobre vyvetrajte. Pri pokusoch dodržiavajte uvedené množstvá.
Chlorovodík je toxický pri vdýchnutí a spôsobuje vážne poleptanie kože a poškodenie očí. - Nevdychujte plyn. PO VDÝCHNUTÍ: Presuňte postihnutého na čerstvý vzduch a nechajte ho oddychovať v polohe, ktorá mu umožní pohodlné dýchanie. - AK SA DOSTANE DO OČI: Opatrne niekoľko minút oplachujte vodou. Ak sú prítomné kontaktné šošovky a je to možné, odstráňte ich. Pokračujte v oplachovaní. Okamžite volajte TOXIKOLOGICKÉ INFORMAČNÉ CENTRUM alebo lekára.
V prípade kyseliny chlorovodíkovej si prečítajte informácie o nebezpečných látkach a zmesiach na str. 7-9.

Koncentrovaná kyselina chlorovodíková sa skladuje v uzatvorených fľašiach, aby sa zabránilo úniku žieravých pár.
Experiment 105
Najprv si preštudujme vodný roztok. Pridajte 1 kvapku kyseliny chlorovodíkovej na malý kúsok lakmusového papierika. Uvidíte silné červené zafarbenie.
Experiment 106
Vykonajte tento experiment vonku alebo v blízkosti otvoreného okna! Do skúmavky nalejte 2 až 3 ml kyseliny chlorovodíkovej, vložte varnú tyčinku a zahrejte. Všimnete si ostrý zápach. Výpary nevdychujte! Kúsok navlhčeného modrého lakmusového papiera podržte pred otvorom skúmavky. Pásik sa zmení na červeno. A2
Aj v tomto experimente kyselina chlorovodíková - roztok chlorovodíka - zmenil lakmusový papierik na červeno. Chlorovodík unikajúci z vodného roztoku sa zviazal s vodnou parou a/alebo vodou zvlhčeného lakmusového papiera za vzniku kyseliny chlorovodíkovej.

Okrem iných toxických plynov , ako je sírovodík a oxid uhoľnatý, sopky chrlia von zo svojich útrob aj chlorovodík.


Príprava chlorovodíka zo stolovej soli a kyseliny sírovej. Plyn sa v ochladenej fľaši rozpúšťa za vzniku kyseliny chlorovodíkovej. Od: Stöckhardt, The School of Chemistry (1863)
Chemické fakty
Kyselina chlorovodíková je vodný roztok plynného chlorovodíka, a odtiaľ pochádza jej názov.
Kyselina chlorovodíkova zo stolovej soli
Kyselina chlorovodíková sa tiež niekedy nazýva kyselina muriatová alebo dokonca destiláty soli. Posledne menovaný staromódny názov je odrazom faktu, že sa vyrába zo stolovej soli, ktorá je 96 - 99% chloridu sodného. V laboratóriu sa kyselina chlorovodíková vyrába z chloridu sodného a koncentrovanej kyseliny sírovej. Experimenty s vysoko žieravou kyselinou sírovou sú u hobby chemikov vylúčené, preto budeme používať ľahšie ovládateľný (ale nie úplne neškodný) hydrogén-síran sodný.
Pre chlorovodík dodržiavajte upozornenia na nebezpečnosť a bezpečnostné upozornenia na str. 65.
V prípade hydrogén-síranu sodného si prečítajte informácie o nebezpečných látkach a zmesiach na str. 7-9.
Nasledujúce dva pokusy vykonajte vonku alebo blízko otvoreného okna..
Experiment 107
V suchej skúmavke, ktorá je upnutá v miernom naklonení s otvoreným koncom nadol, zahrejte zmes 1 lyžice stolovej soli a 1 lyžice hydrogén-síranu sodného. Akonáhle si všimnete ostrý zápach z experimentu 106, ohrievať prestaňte . Zvlhčený kúsok modrého lakmusového papiera, ktorý priložíte pred otvor skúmavky, zčervená. Po ochladení skúmavky, pridajte vodu, aby sa zvyšky rozpustili. A1
Pri zahrievaní chloridu sodného obsiahnutého v stolovej soli s hydrogensíranom sodným sa vytvára síran sodný a chlorovodík, pričom chlorovodík zo zmesi uniká:
NaCl + NaHSO4 → Na2SO4 + HCl↑
chlorid sodný hydrogénsíran sodný síran sodný chlorovodík
Domáca kyselina chlorovodíková
Teraz pripravme vysoko zriedenú kyselinu chlorovodíkovú privádzaním chlorovodíka cez vodu. Valec striekačky bude fungovať ako dobrá absorpčná trubica.
Chemické fakty
Absorpcia znamená pohltenie (napríklad rozpustenie) jednej látky inou (latinsky absorbere = prehltnúť, nasať).
Experiment 108
Zostrojte znázornenú experimentálnu zostavu. Pri vtláčaní sklenenej trubice do gumovej zátky buďte opatrní! Do nádoby, kde bude ponorená striekačka nalejte jednu malú odmerku vody. Striekačka by mala byť ponorená maximálne 2–3 mm. Teraz zohrejte zmes 3 lyžičiek stolovej soli a 3 lyžičiek hydrogén-síranu sodného. Z absorpčnej trubice (naša striekačka) bude najprv unikať niekoľko plynových bublín.
Ak horák nakrátko odstránite, hladina vody v absorpčnej trubici stúpne, čo je znamením toho, že plynný chlorovodík sa vo vode rozpúšťa. Akonáhle produkcia plynu značne ustúpi, ohrievanie zastavte. Stojan so skúmavkou a absorpčnou trubicou trochu nadvihnite , aby kvapalina prúdila späť do ohrievanej skúmavky a následne ju uzavrite zátkou. Po vychladnutí presuňte experimentálnu zostavu na čerstvý vzduch a jej časti nechajte dôkladne vyschnúť. Zahriaty zvyšok sa vo vode rozpustí. A1

Svoju domácu, veľmi zriedenú kyselinu chlorovodíkovú skladujte pre ďalšie experimenty v uzavretej sklenenej nádobe. Na pohár nalepte štítok s textom: „Zriedená kyselina chlorovodíková. Môže dráždiť pokožku a oči. “
V prípade kyseliny chlorovodíkovej a uhličitanu sodného si prečítajte informácie o nebezpečných látkach a zmesiach na str. 7-9.
Experiment 109
Do skúmavky s 1 malou lyžičkou jedlej sódy ( hydrogenuhličitanu sodného) pridajte 1 pipetu vašej vyrobenej kyseliny chlorovodíkovej. Zmes pení. Teraz vykonajte rovnaký experiment so 7% kyselinou chlorovodíkovou. A1
Experiment 110
Do skúmavky naplnenej vodou do polovice, pridajte 1 lyžicu uhličitanu sodného a 3 kvapky lakmusového roztoku.
Trasením rukou zmiešajte s kyselinou chlorovodíkovou, ktorú ste vyrobili. Po 1–2 pipetách sa farba zmení z modrej na ružovo-červenú. Kyselina „ neutralizovala“ zásaditý roztok (pozri kapitolu 14). A1
Od skúšky vodivosti po hydróniový ión
Experiment 111
Podobne ako v experimente 97, použite malú odmernú nádobu a zostrojte skúšobné zariadenie na detekciu elektrickej vodivosti. Do nádoby pridajte 5 ml kyseliny chlorovodíkovej. Žiarovka sa rozsvieti. . A1
Z experimentu 100 už viete, že kyselina chlorovodíková vedie elektrinu. Vodivosť roztokov solí sme vysvetľovali tým, že soli sa v roztoku rozkladajú na kladne a záporne nabité ióny a tie sú zodpovedné za vedenie prúdu. Ako viete z poslednej kapitoly, chlorovodík pozostáva z molekúl spojených kovalentnou väzbou. Kto sa stará o vedenie prúdu? Odpoveďou je - ióny. Vytvárajú sa, keď sa chlorovodík rozpúšťa vo vode. Molekula chlorovodíka sa rozkladá na protón, H+, čo je kladne nabité jadro vodíka a záporne nabitý chloridový ión, Cl-:
HCl → H+ + Cl-
Poznámky pod čiarou
Váš žalúdok tiež produkuje kyselinu chlorovodíkovú
Len si predstavte, že niečo chutné k jedlu môže sliznicu žalúdka vyprovokovať k vylučovaniu žalúdočnej šťavy potrebnej pre trávenie. Jednou z jej dôležitých zložiek je kyselina chlorovodíková. Rozkladá bielkoviny prijaté potravou a tým pomáha enzýmu pepsínu, ktorý bielkoviny štiepi. Kyselina chlorovodíková tiež zabíja baktérie, ktoré sa do tela dostali spolu s jedlom. Aby sa zabránilo samovoľnému tráveniu sliznice žalúdka pôsobením kyseliny chlorovodíkovej a pepsínu, žalúdočná sliznica vylučuje tlmivý hlien, ktorý žalúdok chráni pred natrávaním.
Ak hlienu nie je dostatočné množstvo alebo je kyseliny viac, môže dôjsť k páleniu záhy alebo dokonca bolestivým zápalom sliznice žalúdka. Potom sú potrebné lieky, ktoré viažu kyselinu (napr. magnézium) alebo dokonca také, ktoré bránia nadmernej tvorbe kyseliny.

Kyselina chlorovodíková, zložka žalúdočnej šťavy, podporuje trávenie.

Keď chlorovodík (vodík chlorid je uvedené nesprávne) reaguje s vodou, tvoria sa chloridové ióny, Cl- a hydróniové ióny, H30+ , ktoré spôsobujú kyslú reakciu roztoku.
Malé protóny nemôžu existovať osamote. Hľadajú spojenie s molekulami vody pripojením k jednému z voľných elektrónových párov. Výsledkom sú hydróniové ióny, H3O+. Úplná rovnica pre reakciu medzi chlorovodíkom a vodou je preto:
HCl + H2O → Cl– + H3O+
Chemické fakty
Ióny vodíka sú zodpovedné za kyslú reakciu vodných roztokov, napr. zmena farby lakmusu načerveno.
V experimente 111 sú ióny hydrónia a chloridu to, čo umožňuje roztoku viesť elektrický prúd.

Roztok dusičnanu strieborného plus kyselina chlorovodíková alebo chloridy vytvoria bielu zrazeninu
Detekcia chloridového iónu
Až doteraz ste sa zaoberali kyslou reakciou kyseliny chlorovodíkovej. Charakteristická zložka kyseliny chlorovodíkovej je zvyšok kyseliny alebo, presnejšie: chloridový ión. Už ste oboznámení s činidlom, ktoré sa používa na zistenie kyseliny chlorovodíkovej a jej solí: roztok dusičnanu strieborného. Dusičnan strieborný, AgNO3, je soľ kyseliny dusičnej, HNO3; pri rozpustení vo vode sa rozkladá na ióny striebra, Ag+ a dusičnanové ióny, NO3–.
V prípade roztoku dusičnanu strieborného a roztoku amoniaku si prečítajte informácie o nebezpečných látkach a zmesiach na str. 7-9.
Experiment 112
Do skúmavky s 2 ml vody pridajte 2 kvapky pripravenej kyseliny chlorovodíkovej. Po pridaní 3 až 4 kvapiek roztoku dusičnanu strieborného sa vytvorí táto známa zrazenina; pozostáva z chloridu strieborného, AgCl:
HCl + AgNO3→ AgCl + HNO3

Minerálne horninové striebro alebo chlorargyrit sa skladá z chloridu strieborného - tej istej látky, ktorá sa tvorí pri detekcii chloridov (foto: Dr. R. Hochleitner).
Experiment 113
K zrazenine chloridu strieborného z predchádzajúceho experimentu po kvapkách pridajte roztok amoniaku, skúmavku utesnite a potom ju pretrepte!). Zrazenina sa rozpustí a vytvorí sa číra komplexná zlúčenina (pozri experiment 260). Ak pridáte ocot, opäť sa vytvorí chlorid strieborný. A10
Experiment 114
1 lyžicu kryštálov kuchynskej soli rozpustite v 5 ml vody a pridajte 3 až 4 kvapky roztoku dusičnanu strieborného. Aj tu sa vytvorí chlorid strieborný (mali by ste počkať na zrazeninu pre experiment 115):
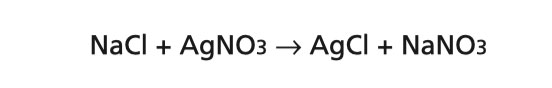
V experimente 112 sa okrem chloridu strieborného vytvára kyselina dusičná a v experimente 114 sa vytvára dusičnan sodný. V obidvoch experimentoch v skutočnosti reaguje len strieborný ión Ag+ a chloridový ión Cl-::
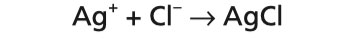
Experiment 115
1 malú lyžičku tiosíranu sodného rozpustite v 3 ml vody a po kvapkách pridajte roztok zrazeniny chloridu strieborného z experimentu 114. Aj v tomto prípade sa vytvorí číry roztok. (pozri experiment 262). A1
Chemické fakty
Kyselina chlorovodíková a chloridy plus dusičnan strieborný vytvárajú bielu zrazeninu, ktorá sa rozpúšťa v roztoku amoniaku a roztoku tiosíranu sodného.
Chlorovodíková fontána
Nasledujúci experiment vykonajte vonku alebo blízko otvoreného okna. Dobre vetrajte. Dodržiavajte uvedené množstvá.
Pre chlorovodík dodržiavajte upozornenia na nebezpečnosť a bezpečnostné upozornenia na str. 65.
V prípade hydrogén-síranu sodného si prečítajte informácie o nebezpečných látkach a zmesiach na str. 7-9.
Pri manipulácii so sklenenými skúmavkami buďte opatrní. Postupujte podľa tipov na strane 15. V prípade poranenia: Prvá pomoc 7 (vo vnútri predného obalu).
Experiment 116
Dodatočný materiál: Vata
Zostrojte experimentálnu zostavu podľa obrázka. Dlhé rameno zahnutej trubice pretiahnite kúskom vaty a ponorte ho do prázdnej suchej skúmavky. Na špicatú sklenenú trubicu nasuňte zátku s jedným otvorom, ako je to znázornené na strednom obrázku. Malý pohár so skrutkovým uzáverom naplňte do polovice vodou a pridajte do neho 8 - 10 kvapiek lakmusového roztoku. Ako predtým, zahrejte zmes 3 lyžičiek stolovej soli a 3 lyžičiek hydrogén -síranu sodného . Keď zacítite zreteľný ostrý zápach, ohrev odstavte. Skúmavku naplnenú plynom uzavrite pripravenou zátkou (so špicatou trubicou) a položte ju sklenenou trubicou smerom nadol, do nádoby s modrým lakmusovým roztokom . Kvapalina do skúmavky pomaly stúpa a potom do nej rýchlo vstrelí. Modrý roztok sa zmení na červený. Zvyšok ohrevu: A2
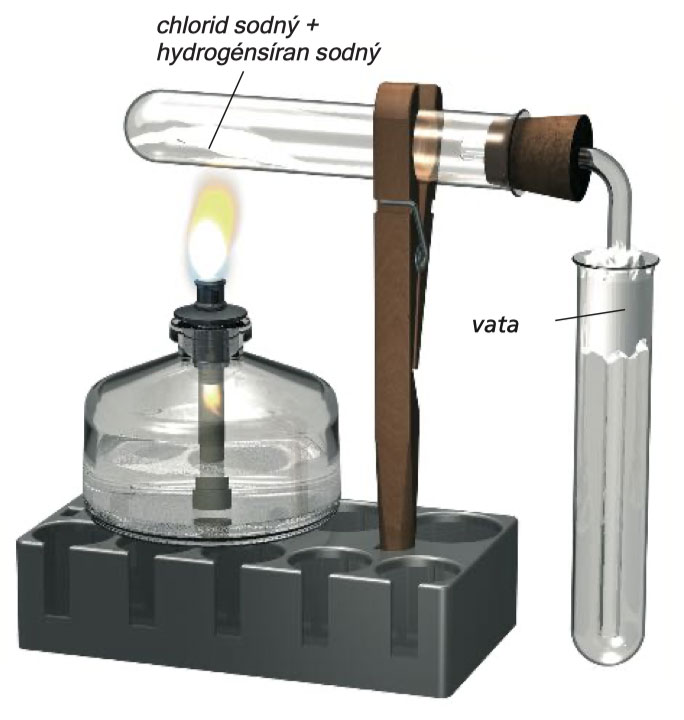
Fontána chlorovodíka. Hore: príprava chlorovodíka; nižšie: fontána
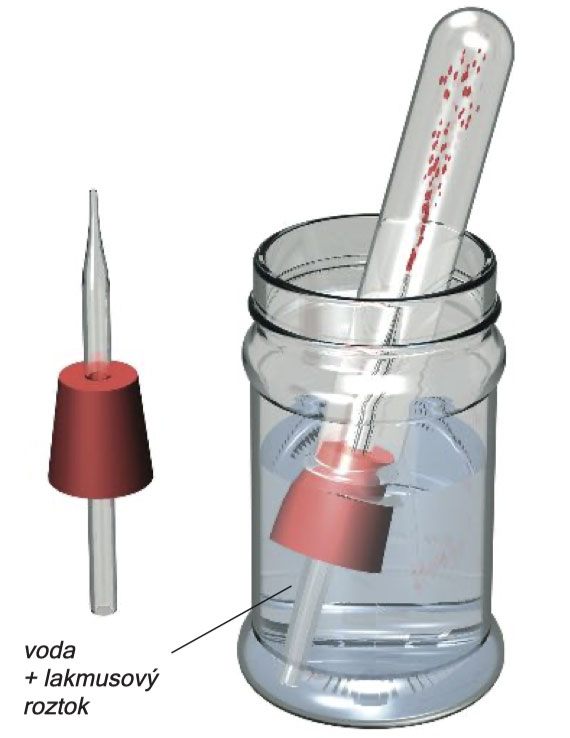

Experiment s fontánou v trochu väčšom meradle
Chlór
Chlór (lat. chlorum) je chemický prvok, ktorý má značku Cl a protónové číslo 17. Je to toxický, za normálnych podmienok žltozelený plyn s charakteristickým zápachom. Priemyselne sa využíva ako oxidačné činidlo, na dezinfekciu vody a ako bieliace činidlo.
Na Zemi sa chlór vďaka svojej reaktívnosti nachádza iba vo forme zlúčenín, väčšinou rozpustných vo vode.
Viac nájdete na wikipédii tu

Chlorovodík má veľkú vášeň: vodu. Približne 450 l chlorovodíka sa pri 20 °C rozpustí v 1l vody. Tým vznikne koncentrovaná kyselina chlorovodíková. V našom experimente sa najskôr v úzkej sklenenej trubici rozpusti len malé množstvo chlorovodíka. Vonkajší tlak vzduchu spočiatku tlačí vodný stĺpec dovnútra skúmavky len pomaly. Keď sa však prvé kvapky vynoria zo špičky tenkej trubice, veľká časť plynného chlorovodíka sa rýchlo rozpustí a tlak vzduchu vtlačí vodu do skúmavky ochudobnenej o plynný chlorovodík. Fontána vďaka tomu funguje.
Chemické fakty
Pri 20 °C sa 450 l chlorovodíka rozpustí v 1 l vody.
Toxický plyn a dezinfekčné prostriedky
Teraz sa stretnete s plynom, ktorého vôňa môže byť známa z bazénov. Na niektorých miestach sa pridáva aj do pitnej vody. V oboch prípadoch je jej účelom dezinfekcia. Kým chloridové ióny, Cl-, sú v roztoku kuchynskej soli (a vo vašej polievke!) celkom neškodné, chlór (zložený z molekúl Cl2) je agresívny, toxický plyn. Je veľkým rozdielom, či má atóm chlóru ďalší elektrón na doplnenie svojej valenčnej vrstvy od atómu sodíka alebo od iného atómu chlóru.
Z bezpečnostných dôvodov budeme experimentovať len s veľmi malým množstvom plynu a zvyšný chlór bude zneškodnený pomocou „zneškodnovača chlóru“. Mimochodom, chlór dostal názov odvodený od jeho farby (grécky chloros = žltkastozelený).
Pokusy s chlórom vykonajte vonku alebo v blízkosti otvoreného okna. Po experimente dobre vyvetrajte. Dodržiavajte uvedené množstvá.
Chlór je toxický pri vdýchnutí, spôsobuje vážne podráždenie očí, podráždenie pokožky a môže spôsobiť podráždenie dýchacích ciest. Nevdychujte plyn. - AK VDÝCHNUTÝ: Presuňte postihnutého na čerstvý vzduch a nechajte ho oddychovať v polohe, ktorá mu umožní pohodlné dýchanie. Zavolajte TOXIKOLOGICKÉ INFORMAČNÉ CENTRUM alebo lekára. - AK SA DOSTANE DO OČI: Opatrne niekoľko minút oplachujte vodou. Ak sú prítomné kontaktné šošovky a je to možné, odstráňte ich. Pokračujte v oplachovaní. - Ak pretrváva podráždenie očí: Vyhľadajte lekársku pomoc.
V prípade manganistanu draselného a kyseliny chlorovodíkovej si prečítajte informácie o nebezpečných látkach a zmesiach na str.7-9
Experiment 117
Na stenu malej nádoby nalepte 1 cm dlhý navlhčený kúsok modrého lakmusového papierika, ako je to znázornené na obrázku. Do nádoby vložte 1 malú špičku (!) lyžice manganistanu draselného a pridajte 1 pipetu kyseliny chlorovodíkovej. Nádobu uzavrite. Lakmusový papierik najprv zmení farbu na načervenalú (kvôli parám kyseliny chlorovodíkovej), potom postupne mizne. Uzavretú odmernú nádobu uchovajte pre ďalší experiment.
Manganistan draselný uvoľnil kyslík, ktorý uvoľnil chlór z kyseliny chlorovodíkovej. Toto môže byť vyjadrené v zjednodušenej forme takto: 2 HCl + O → H2O + Cl2
Chlór odfarbil lakmusové farbivo.
Experiment 118
1 lyžicu tiosíranu sodného rozpustite v 3 ml vody. Otvorte odmernú nádobu z predchádzajúceho pokusu a mávnutím ruky opatrne privoňajte k parám, ktoré z nádoby unikajú.
Všimnete si typický zápach chlóru. Teraz do nádoby pridajte tiosíran sodný. Čoskoro sa vytvorí mliečne, žltkasté zakalenie. Znovu privoňajte. Zápach chlóru zmizol! Pravdepodobne si všimnete ďalší zvláštny zápach, ktorý vám pripomenie pach spálenej síry. A1
Tiosíran sodný spôsobuje presný opak toho, čo ste videli v experimente 117: chlór sa premení späť na chlorid. Zároveň sa uvoľňuje trochu oxidu siričitého (z ktorého pochádza zápach spálenej síry). Tiosíran sodný sa používa na odstránenie zvyškového chlóru a preto sa tiež nazýva „anti-chlór“.
Jednoduchšie na zaobchádzanie: chlórová voda
Chlór je mierne rozpustný vo vode: približne 2,3 l plynného chlóru sa rozpustí v 1 l vody pri 20 °C. Pre hobby chemikov je experimentovanie s chlórovou vodou pohodlnejšie a menej nebezpečné ako manipulácia s plynom. Napriek tomu by ste mali mať pri ďalšom experimente asistenta .

Zber chlóru cez roztok kuchynskej soli, ktorý sa chlórom nerozpúšťa.
Od: Heumann, Anorganická chémia (1893).
Pre nasledujúce experimenty tiež sledujte poznámky o zaobchádzaní s chlórom, manganistanom draselným a kyselinou chlorovodíkovou na str. 70! Vykonajte tieto experimenty vonku alebo blízko otvoreného okna! Pri manipulácii so sklenenými skúmavkami buďte opatrní. Postupujte podľa tipov na strane 15. V prípade zranenia: Prvá pomoc 7 (vo vnútri predného obalu).
Experiment 119
Dodatočný materiál: štipec na bielizeň
Pre tento a nasledujúce experimenty pripravte roztok tiosíranu sodného ( rozpustite 3 lyžice tiosíranu sodného v 20 ml vody) a pripravte skúmavku napoly naplnenú vodou.
Zostrojte experimentálnu zostavu, ako je to znázornené na obrázku, a do skúmavky vložte 1 lyžicu zmesi manganistanu draselného a 4 ml 7 % kyseliny chlorovodíkovej. Erlenmeyerova banka obsahuje 100 ml vody. Aktívne uhlie sa nachádza v hornej časti absorpčnej trubice medzi tesne priliehajúcimi zväzkami bavlny alebo papierovej utierky , čím sa vytvára filter s aktívnym uhlím. Dlhá gumová hadica je upnutá pomocou štipca na prádlo.
Zmes manganistanu draselného a kyseliny chlorovodíkovej opatrne zahrejte opakovaným odťahovaním horáka nabok. Žiadna z tmavých kvapalín by sa nemala dostať do zahnutej trubice. Plyn prebubláva vodou v banke. Keď tvorba plynu ustane a voda vystúpi z banky späť do šikmej trubice, odstráňte štipec na bielizeň a uhaste horák.


Bieliace činidlá na báze chlóru nie sú neškodné. Ak sa pridajú kyslé čistiace prostriedky, vytvorí sa chlór.
Hrdlo Erlenmeyerovej banky držte jednou rukou, zátku na nej druhou rukou a požiadajte asistenta, aby odtiahol horák. Vymeňte Erlenmeyerovu banku za pripravenú skúmavku, ktorú by ste mali naďalej držať. Voľnou rukou zatvorte Erlenmeyerovu banku a odložte ju nabok. Požiadajte svojho asistenta, aby skúmavku upnutú v stojane pomaly spúšťal dole, až kým obe skúmavky nestoja na pracovnom povrchu.
Teraz pridajte (cez hadicu) do skúmavky, ktorú ste zohrievali 2 - 3 pipety roztoku tiosíranu sodného. Ten odstráni väčšinu chlóru. Najlepšie však bude, ak experimentálnu zostavu rozoberiete vonku (na balkóne je to v poriadku) a všetky jej časti necháte dobre vysušiť. Do reakčnej zmesi pridajte 2 ml roztoku hydroxidu sodného (opatrný, žieravina!) a prefiltrujte. Filtrát: A1, zvyšok na filtri: A6
Chlórovú vodu uložte do čistej fľaše. Označte ju štítkom s textom: „Chlórová voda. Toxické. Nevdychujte výpary! “
Experiment 120
Do skúmavky vložte malý kúsok modrého lakmusového papierika a pridajte k nemu 5 ml chlórovej vody. Lakmusový papierik rýchlo vybledne a všimnete si zápach chlóru. Pridajte k tomu trochu roztoku tiosíranu sodného a pretrepte ho! Zápach chlóru zmizne. A1
Pri nasledujúcom pokuse na detekciu chlóru budete musieť urobiť škrobový roztok. Pozrite sa na tip na strane 79, aby ste zistili, ako na to.
Experiment 121
V 5ml vody rozpustite niekoľko kryštálov jodidu draselného a pridajte k nemu niekoľko kvapiek roztoku škrobu. Ak po kvapkách pridáte chlórovú vodu, vznikne tmavomodrý roztok. Chlórová voda uvoľnila jód z roztoku jodidu draselného, ktorý tvorí modrý komplex škrobu a jódu (viac v nasledujúcej kapitole). A9
Chemické fakty
Menej nebezpečná chlórová voda vykazuje rovnaké reakcie, ako sú charakteristické pre plynný chlór.
Elektrolýza roztoku kuchynskej soli
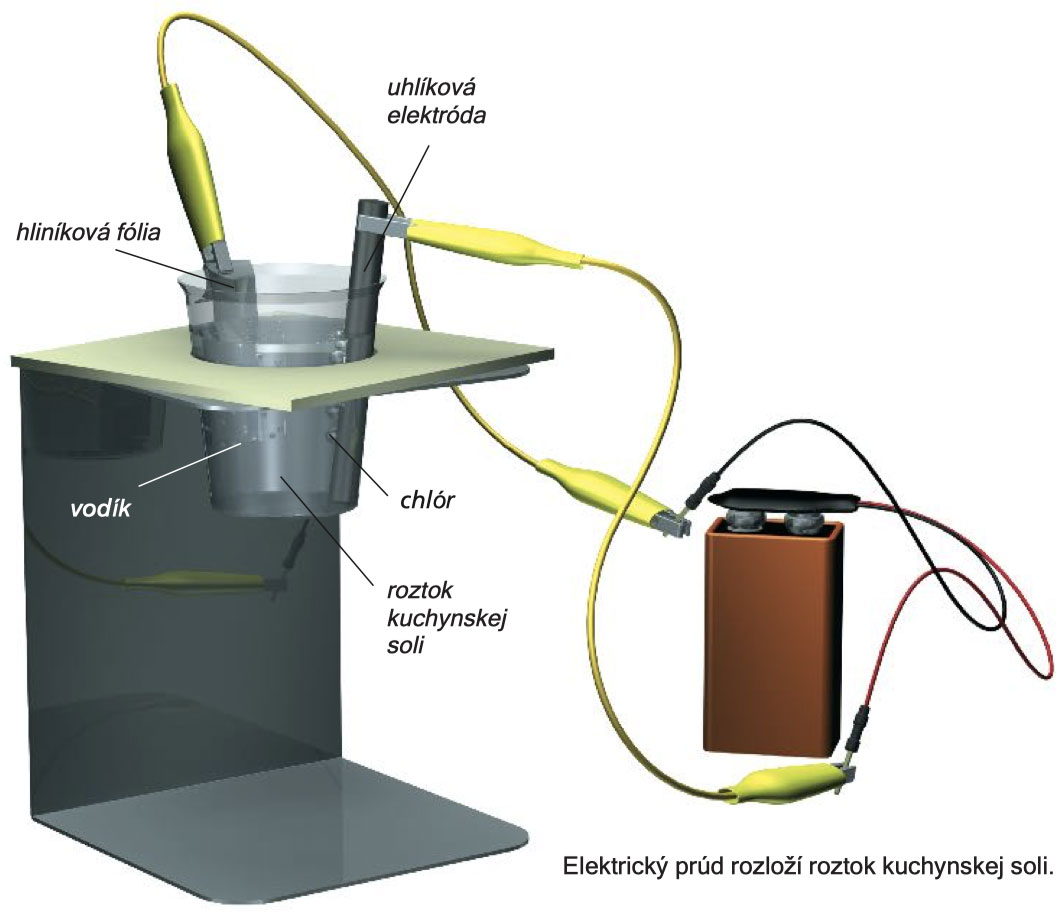
Experiment 122
Naplňte malú odmerku do dvoch tretín soľným roztokom a zostrojte experimentálnu zostavu , ako je to znázornené na obrázku. Po uzavretí obvodu sa začne na oboch elektródach tvoriť plyn : silnejšie na katóde a menej na anóde . Na katódu zatlačte kus červeného lakmusového papierika . Modrý alebo červený lakmusový papierik pritlačte na uhlíkovú tyčinku: Testovací prúžok sa odfarbí v mieste kontaktu. A1
Ako viete, chlorid sodný sa skladá zo sodíkových iónov, Na+ a chloridových iónov, Cl-. Vo vodnom roztoku sa kryštalická mriežka rozkladá a ióny sa v roztoku voľne pohybujú. Ak je na elektródy privedené priame napätie, potom je na anóde nedostatok elektrónov a na katóde ich prebytok. Zdroj priameho napätia je niečo ako „elektrónové čerpadlo“: nasáva elektróny na anóde a uvoľňuje elektróny na katóde. Ióny CI- sú priťahované anódou. Tam strácajú svoj ôsmy valenčný elektrón a odchádzajú ako molekula chlóru, Cl2. Vytvorí sa trochu chlórovej vody. Ióny Na+ migrujú na katódu, ale nemôžu sa vyzrážať ako kovové sodíky (vysoko neušľachtilý kov by okamžite reagoval s vodou).
Namiesto toho sa voda štiepi:
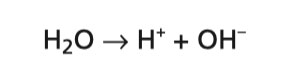
Vodíkové ióny, H+, prijmú elektróny , ktoré sú hojne prítomné na katóde a unikajú ako molekuly vodíka , H2. Ióny OH- sú zodpovedné za zásaditú reakciu v katódovej komore (modré sfarbenie červeného lakmusového papierika).
Experiment 123
Povedzme, že máte zdroj napätia, ktorému chýba označenie plus a mínus. Predchádzajúci experiment môžete využiť na to, aby ste zistili, ktorý je plusový a ktorý mínusový terminál. Namočte kus červeného lakmusového papiera do roztoku kuchynskej soli a položte ho na pevný povrch. Konce vodičov, ktoré sú pripojené k batérii napojte na vlhký lakmusový papier a čoskoro budete vedieť, ktorý je záporný terminál. A3
Technológie a životné prostredie
Soľ solí...
... je samozrejme kuchynská soľ, ktorá ako už bolo spomenuté - sa skladá z 99% chloridu sodného. Teraz viete, že pre chemika sú soli látky, ktoré sú vytvorené z kovových a nekovových iónov. Nie je to však náhoda, že kuchynská soľ dala celej skupine látok svoje meno, pretože je to zlúčenina, ktorá je nevyhnutná aj pre život a životne dôležitá surovina.
Soľ sa vyrába rôznymi spôsobmi. V horúcich, suchých oblastiach sa morská voda, ktorá obsahuje asi 27 g soli na liter , môže odpariť v plytkých bazénoch. Takto získaná soľ sa nazýva morská soľ.
Soli zo starých morí , ktoré už dávno zmizli, vytvorili podzemné vrstvy až do hrúbky 1000 m. Táto vyťažená soľ sa vhodne nazýva kamenná soľ..
Voda sa používa na rozpustenie soli z horniny s jej vysokým obsahom. Koncentrované roztoky, nazývané soľanka, sa varia vo výparníkoch, kým soľ nevykryštalizuje, zatiaľ čo ťažšie horniny sa usádzajú na dno.
Chlorid sodný je nevyhnutný pre ľudí a zvieratá. Ióny sodíka sa okrem iného podieľajú na prenose nervových impulzov a na svalových vzruchoch. Ľudské bytosti potrebujú 2 - 3 g kuchynskej soli každý deň a až 15 g pri vykonávaní namáhavej fyzickej práce.
Ale ani chemický priemysel nemôže byť bez soli života. Pomocou chlóralkalickej elektrolýzy sa vyrába chlór, vodík a hydroxid sodný - suroviny používané v mnohých látkach a výrobkoch.

Produkcia soli z morskej vody (foto: Lutz Travira)


Výparník, v ktorom sa soľanka zohrieva až do vykryštalizovania stolovej soli (foto: Saline Bad Reichenhall)

Elektrolýzou chlóralkália sa získa chlór, vodík a hydroxid sodný (foto: Lurgi)
