V kapitole 3 ste sa dozvedeli o dvoch spôsoboch separácie zmesi do jej zložiek: dekantácia (usadzovanie) a sublimácia (odparovanie). V tejto kapitole si vyskúšate iné metódy používané odborníkmi na separáciu zložiek zmesí.
Filter z papiera
Pri použití metódy dekantácie (usadzovania), nie je možné úplne oddeliť kvapalinu od sedimentu (usadeniny). Funguje to lepšie filtráciou . Na to použijete filtračný papier , ktorý funguje ako jemné sito . Póry papiera sú dostatočne veľké , aby umožnili kvapaline pretiecť , ale pevné častice, ak nie sú tiež malé, aby papierom pretiekli, sú zadržiavané.
Krúžok filtračného papiera zložte pozdĺž červených vyznačených čiar tak ako vidíte na ilustráciách vpravo. Vznikne vám kužeľovitý útvar pozostávajúci z jednej vrstvy filtračného papiera na jednej strane a troch vrstiev na strane druhej. Kužeľ vložte do lievika a jemne ho navlhčite vodou tak, aby sa papier prilepil k stenám lievika. Lievik vložte do prázdnej skúmavky.
Experiment 19
Do skúmavky nasypte 2 plné lyžice piesku a doplňte ju do jednej polovice vodou. Obsah skúmavky poriadne pretrepte a cez filtračný papier ju prelejte do prázdnej skúmavky. Čistá kvapalina tečúca do skúmavky – v tomto prípade voda – sa nazýva filtrát. Piesok zostáva zachytený na povrchu filtračného papiera. A1, A3
Piesok je tvorený drobnými kryštálikmi kremeňa. Tie sú vo vode nerozpustné a sú relatívne ťažké, takže po nasypaní do vody klesnú na dno. Zrnká kremeňa sú taktiež príliš veľké na to, aby prenikli cez otvory vo filtračnom papieri, ktorý plní funkciu extrémne jemného sita.
Experiment 20
Zmes 1 lyžice piesku a stolovej soli prefiltrujte v 10 ml vody. Filtrát uschovajte pre ďalší experiment.
V prípade denaturovaného alkoholu a kyseliny chlorovodíkovej si prečítajte informácie o „ nebezpečných látkach a zmesiach“ na str. 7-9.
Testovanie na chlorid dusičnanom strieborným
V predchádzajúcom experimente ste vyrobili roztok kuchynskej soli, keď ste oddelili piesok a soľ. Aby ste dokázali, že pracujete s roztokom soli, nemusíte nevyhnutne použiť metódu odparovania. Použijete činidlo: roztok dusičnanu strieborného. Keďže roztok dusičnanu strieborného je drahý a škodlivý pre životné prostredie, budete musieť s obsahom fľaštičky zaobchádzať šetrne. Dbajte na dodržanie uvedených hodnôt a činidlo pridávajte po kvapkách.

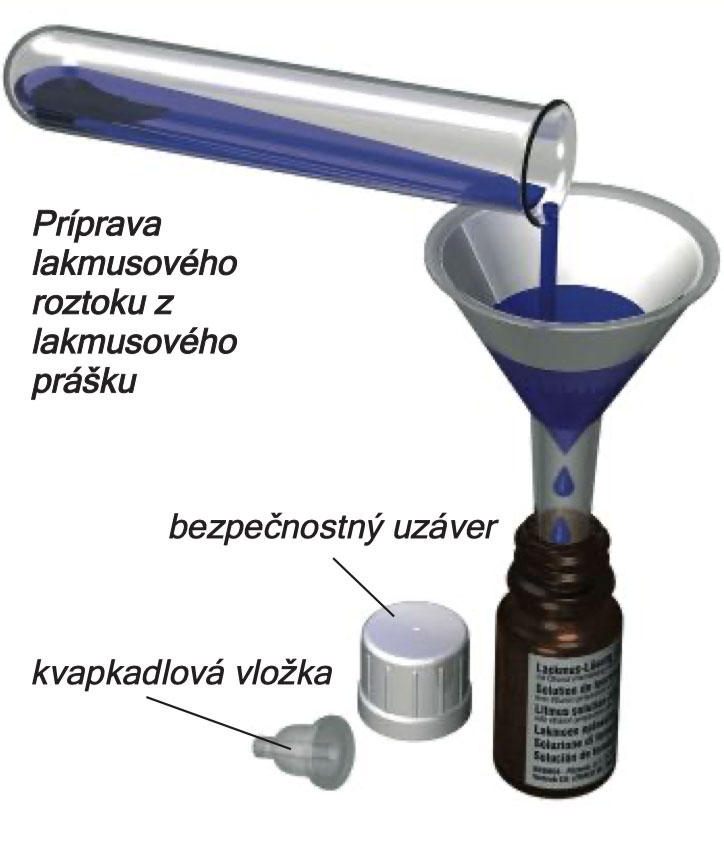
Výroba lakmusového roztoku
Vaša experimentálna súprava C3000 obsahuje lakmusový prášok, z ktorého si vyrobíte tmavomodrý lakmusový roztok. Ako súčasť experimentov, ktoré vás čakajú, budete používať a pracovať s týmto roztokom alebo s prúžkami filtračného papiera saturovanými lakmusovým roztokom : lakmusovými papierikmi.
Lakmusový prášok nie je tvorený len jedným druhom materiálu. Je zmesou prísad pochádzajúcich z rôznych rastlín známych ako lišajníky. Lakmusový roztok vydrží len určitú dobu a v prípade, že ho uskladňujete príliš dlho, sa môže jeho vôňa zmeniť (suchý prášok má zemitú vôňu). Množstvo prášku, ktoré nájdete v balení súpravy by malo byť dostačujúce na prípravu troch dávok lakmusového roztoku. Na jednu dávku použite 3 malé rovné lyžičky lakmusového prášku. Tie nasypte do skúmavky, pridajte objem vody, ktorý búde siahať do výšky 3 cm, skúmavku uzavrite a obsah v nej pretraste. Zavretú skúmavku nechajte deň odstáť na mieste bezpečne mimo dosah malých detí.
Ako ďalší krok umiestnite lievik s filtračným papierikom vnútri do nádobky označenej ,,lakmusový roztok‘‘. Obsah skúmavky po odstátí prelejte do nádobky cez filtračný papierik. Usadenina, ktorá zostane v skúmavke a na filtračnom papieri môže byť bezpečne vyhodená do komunálneho odpadu.
Životnosť lakmusového roztoku môžete predĺžiť pridaním polovice pipety denaturovaného alkoholu. Poproste svojho dospelého pomocníka, aby vám s týmto krokom pomohol. Fľaštičku uzavrite bezpečnostným uzáverom – kvapkadlo sa zasunie do hrdla fľaštičky. Na to, aby ste mohli do fľaštičky roztok po spotrebovaní doplniť, bude nutné najprv odstrániť kvapkaciu vložku ( poproste dospelú osobu o pomoc). Ilustrácie na obrázkoch naľavo vám napovedajú, ako bezpečnostný uzáver otvárať a zatvárať súčasným zatlačením nadol a otáčaním. Teraz už je váš lakmusový roztok hotový a pripravený na použitie. Pokyny k výrobe lakmusových papierikov nájdete uvedené tesne pred popisom Experimentu 45.

Striebro
Striebro, chemická značka Ag (lat. Argentum) je ušľachtilý kov bielej farby, používaný človekom už od staroveku. Vyznačuje sa najlepšou elektrickou a tepelnou vodivosťou zo všetkých známych kovov. Slúži ako súčasť rôznych zliatin. Je vhodné na použitie v elektronickom priemysle, pri výrobe CD aj DVD nosičov a v šperkárstve. Jeho zlúčeniny sú potrebné pre fotografický priemysel.
Viac informácií nájdeš na wikipédii tu.

V prípade roztoku dusičnanu strieborného si prečítajte informácie o nebezpečných látkach a zmesiach na str. 7-9.
Experiment 21
Pridajte 5 kvapiek roztoku dusičnanu strieborného do 2 ml filtrátu z Experimentu 20. Získate bielu zrazeninu. A10
Zrazenina označuje kyselinu chlorovodíkovú a chlorid (viac v kapitole 10). Hlavnou zložkou stolovej soli je chlorid sodný.
Ak je vaša voda z vodovodu „tvrdá“ (opýtajte sa rodičov), mali by ste na experimenty s roztokom dusičnanu strieborného použiť destilovanú (demineralizovanú) vodu. Minerály obsiahnuté v tvrdej vode môžu tiež produkovať zrazeniny.
Skupenstvá látok
Pravdepodobne viete, že voda sa vyskytuje sa v troch základných formách:
ľad - tuhé skupenstvo
voda – kvapalné skupenstvo
para – plynné skupenstvo
Aj iné látky sa môžu vyskytovať v týchto troch základných skupenstvách a to v závislosti na prevládajúcich podmienkach, najmä teploty a tlaku.
Keď má voda menej ako 0°C, pri normálnom tlaku (pri zemskom povrchu) je tuhá, v rozpätí 0 až 100° Celsia je kvapalná a pri 100°C začne vrieť a prudko sa meniť na plyn. Voda sa vyparuje aj pri nižšej teplote, dokonca sa môže vyparovať priamo z ľadu – voláme to sublimácia. Keď v zime zavesíte na balkóne mokrú bielizeň a teplota je pod bodom mrazu, voda v bielizni zmrzne, ale po čase sa z nej voda vyparí (vysublimuje), ak sú na to vytvorené vhodné podmienky (vzduch je dostatočne suchý a fúka vietor). Voda tiež môže vrieť pri oveľa nižšej teplote ako 100°C a to pri klesajúcom tlaku vzduchu. Napríklad na najvyššej hore sveta Mt. Evereste voda vrie pri teplote 70°C, pretože je tam oveľa menej vzduchu (a teda nižší tlak vzduchu) ako pri zemskom povrchu.
To, čo sme ukázali na príklade vody, platí aj pre väčšinu ostatných látok . Pri dostatočne vysokých alebo nízkych teplotách sa môžu objaviť vo všetkých troch stavoch. Železo sa topí pri teplote 1 535 °C a odparuje (mení sa na plyn) pri teplote okolo 2 750 °C.
Častice látky sú v neustálom pohybe . V pevnom stave (kryštálová mriežka ) je ich kinetická (pohybová ) energia nízka . Častice len vibrujú okolo svojich rovnovážnych polôh. Keď sa teplota zvýši, t.j. dodá sa energia, molekuly vibrujú silnejšie a narážajú na seba. Vyhrievaný materiál expanduje - zväčšuje sa . Ďalšie zahrievanie zvyšuje kinetickú energiu častíc tak , že opúšťajú svoje rovnovážne polohy, kryštálová mriežka sa vplyvom gravitácie zrúti: Materiál sa taví, ale väčšina častíc zostáva spolu, lebo nedokážu prekonať gravitačné pôsobenie a vzájomnú príťažlivosť. Keď sa teplota ďalej zvýši, molekuly nadobudnú takú rýchlosť, že niektoré z nich prekonajú silu vzájomnej príťažlivosti i gravitačnú silu a poletujú po miestnosti či nádobe všetkými smermi - látka sa odparí.

Experiment 22
Odparovaciu misku s niekoľkými kvapkami vody položte na suché miesto. Voda sa po chvíli odparila.
Skutočnosť, že vodná para zaberá oveľa viac miesta ako zodpovedajúce množstvo vody v kvapalnom skupenstve, je demonštrovaná v nasledujúcom experimente.
Pri manipulácii so sklenenými skúmavkami buďte opatrní. Poznačte si informácie na str. 15. V prípade zranenia: Prvá pomoc 7 (vo vnútri predného obalu).
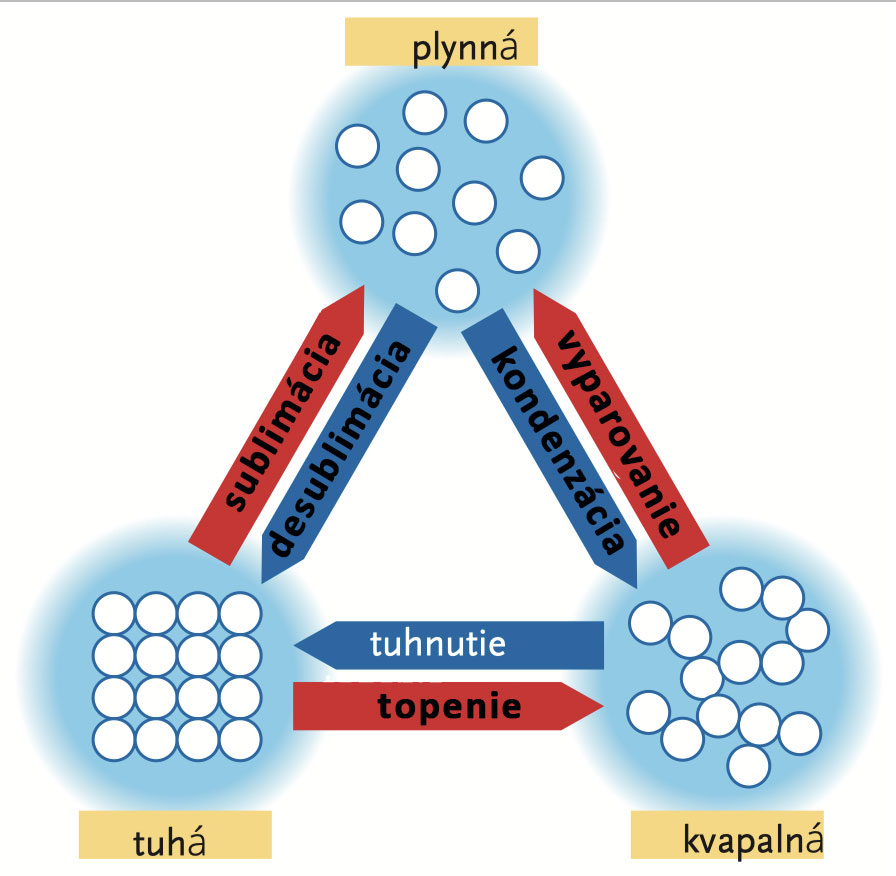
Experiment 23
Špicatú sklenenú trubicu zasuňte do zátky tak, ako je znázornené na obrázku. Skúmavku upnite do držiaka, nalejte do nej trochu vody a ohrejte do varu. Rýchlo nasuňte na hrdlo skúmavky zátku so špicatou trubicou a vložte hore dnom do kadičky s vodou. Voda vystúpi do sklenenej trubice, vstrekne vodu do skúmavky a do polovice ju zaplní vodou.
Čo sa stalo? Vodná para v skúmavke sa rýchlo ochladzuje. Časť pary sa pri tomto ochladení opäť zmení na vodu. Tento proces, ktorý sa po sprchovaní odohráva na každom kúpeľňovom zrkadle, volá kondenzácia. Kondenzovaná voda potrebuje v skúmavke menej miesta ako vodná para, preto je vzduch v skúmavke redší - je tam menší tlak a preto tlak vzduchu mimo skúmavky vtlačí vodu z kadičky do skúmavky.
Experiment 24
Do malej nádoby od zaváraniny pridajte zmes 30 g stolovej soli a 90 g snehu alebo práškového ľadu (odvážte kuchynskou váhou). Vložte skúmavku s niekoľkými mililitrami vody do mraziacej zmesi. Po niekoľkých minútach voda v skúmavke zamrzne. Tento druh zmesi ľadu a solí (budete sa učiť o iných soliach okrem stolovej soli) môžete využiť na vytvorenie teploty až -55 °C.
So stolovou soľou vytvoríte najnižšiu teplotu -20 °C.
Ako môžeme vysvetliť chladiaci efekt? Rozpustenie soli a roztopenie ľadu vyžadujú energiu, ktorá je odobraná zo zmesi. Toto odobratie energie sa prejaví ochladením.

Tlak vo vnútri propánovej nádrže je 24násobok normálneho tlaku vzduchu.
Experiment 25
Do Erlenmeyerovej banky nalejte asi 20 ml vody, banku upevnite do držiaka na skúmavky, položte na stojan horáka s drôteným pletivom a priveďte do varu. Voda naozaj musí bublať. Odoberte ju z plameňa, utesnite ju gumovou zátkou a podržte ju pod studenou tečúcou vodou. Obsah banky opäť začne vrieť.
Ako ste videli v pokuse 23, vodná para kondenzuje na vodu, keď je ochladená. Tým vzniká v banke nižší tlak, pretože vzduch je redší a tieto podmienky znižujú teplotu varu. Podtlak je tiež zrejmý, ak chcete z banky odstrániť zátku. S týmto vám môže pomôcť dospelá osoba.
Môžete tiež zvýšiť teplotu varu (a udržať tak látku v kvapalnom skupenstve) zvýšením tlaku. Toto je technika používaná na skvapalňovanie plynov. Propán má teplotu varu -45 °C, čo znamená, že nad touto teplotou je plynný. Použitím tlaku sa môže teplota varu propánu zvýšiť tak, že je kvapalný aj pri teplote miestnosti. V oceľových nádobách, v ktorých sa predáva ako „ kvapalný propán“, je tlak približne 24 500 hPa - približne 24-násobok normálneho tlaku vzduchu.
Chemické fakty
Znížený tlak vedie k nižšiemu bodu varu. Zvýšený tlak vedie k vyššiemu bodu varu.
Domáca destilovaná voda
Jedna z pracovných techník, pri ktorej sa odparovanie a kondenzácia pohybujú ruka v ruke , je známa ako destilácia (latinčina destillare = odkvapkávanie ), ktorá sa okrem iného používa na oddelovanie kvapalných a pevných látok.
V prípade síranu amónneho (III) a roztoku dusičnanu strieborného si prečítajte informácie o „nebezpečných látkach a zmesiach“ na str. 7-9. Pri manipulácii so sklenenými skúmavkami buďte opatrní. Poznačte si informácie na str. 15. V prípade zranenia: Prvá pomoc 7 (vo vnútri predného obalu).
Experiment 26
Do Erlenmeyerovej banky pridajte 30 ml vody spolu s 1 malou lyžičkou síranu železitého amónneho a 1 malou lyžičkou stolovej soli. Asi 5 ml roztoku otestuje roztokom hexakyanoferátu draselného (II) na prítomnosť železa, ako bolo uvedené v experimente 15. Do 2ml roztoku pridajte 5 kvapiek roztoku dusičnanu strieborného na otestovanie prítomnosti chloridu. Tieto rozpustené látky sa v roztoku prejavia modrou alebo bielou zrazeninou. A1, A10
Zostavte experimentálne zariadenie, ako je to znázornené na ilustrácii (nezabudnite na sklenené guličky, alebo uprednostnite kamene na eliminovanie búrlivého varu) a Erlenmeyerovu banku zohrejte do varu. Para unikne zo zostupujúcej sklenenej trubice a časť z nej kondenzuje na čistú kvapalinu v skúmavke chladenej vodou. Vaša destilačná aparatúra nie je veľmi efektívna, pretože výťažok z kondenzácie - kondenzát alebo destilát, je malý.
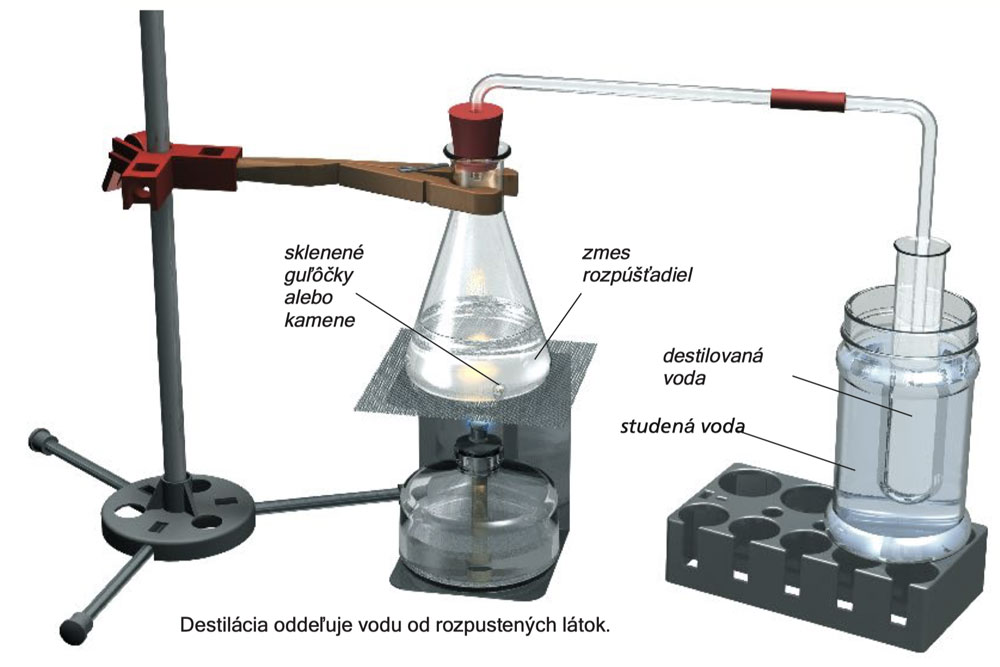
Experiment 27
Testujte 5 ml a 2 ml množstvá destilátu na prítomnosť železa a chloridu, ako je opísané vyššie. Vzorky budú negatívne . A 1, A10
Destilát je bez prísad. Je to jednoducho len destilovaná voda. V laboratóriu sa používa destilovaná voda (tiež známa ako demineralizovaná voda), pretože voda z vodovodu obsahuje minerály, ktoré môžu nechcene ovplyvňovať skúmané chemické reakcie.
Takže môžete použiť destiláciu na oddelenie rozpúšťadla od rozpustených látok v prípadoch, kde tieto rozpustené látky majú oveľa vyššiu teplotu varu ako rozpúšťadlo. Vo všeobecnosti ide o pevné látky. Po zahriatí rozpúšťadlo prechádza do plynného stavu, zatiaľ čo rozpustené látky (ako je síran amónny železitý a stolová soľ) zostávajú v Erlenmeyerovej banke.
Experiment 28
Urobte skúšku obsahu banky na železo roztokom hexakyanoželezitanu draselného(II). A1
Experiment 29
Do 2ml obsahu banky pridajte 5 kvapiek roztoku dusičnanu strieborného. A10
Ako vidíte rozpustené látky zostali v banke.
Ak chcete pri procese destilácie získať odparujúcu sa látku, môžete vzniknutú paru chladiť účinnými vodnými chladičmi. Ak na druhej strane chcete oddeliť rozpustenú látku, môžete to urobiť v mnohých prípadoch jej prevarením. V tomto procese obsah rozpustenej látky v roztoku stúpa až do úplného odparenia rozpúšťadla.

Destilácia v chemickom laboratóriu. Odparovacia banka naplnená žltou kvapalinou sa otáča vo vyhrievanom kúpeli. Stúpajúce pary kondenzujú na chladnejších sklenených zvitkoch, ktorými prechádza studená voda. Bezfarebný destilát sa zbiera v zbernej banke.
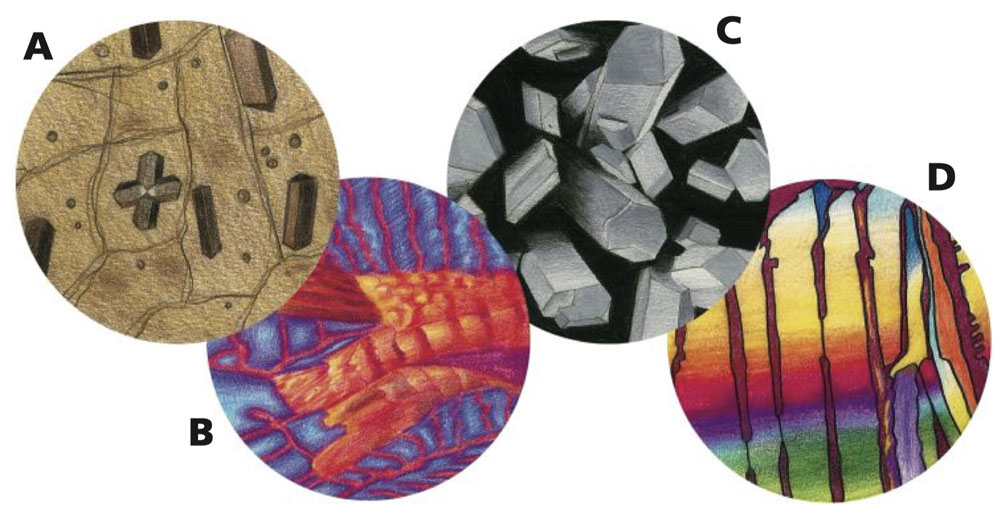
Kryštály cez objektív mikroskopu (a pod polarizovaným svetlom)
A kryštály v hnedej cibuľovej koži
B kryštály aspirínu
C kryštály vitamínu C
D kryštály cukrovej repy

Kryštalizátory pre roztoky obsahujúce soľ (foto: Lurgi)
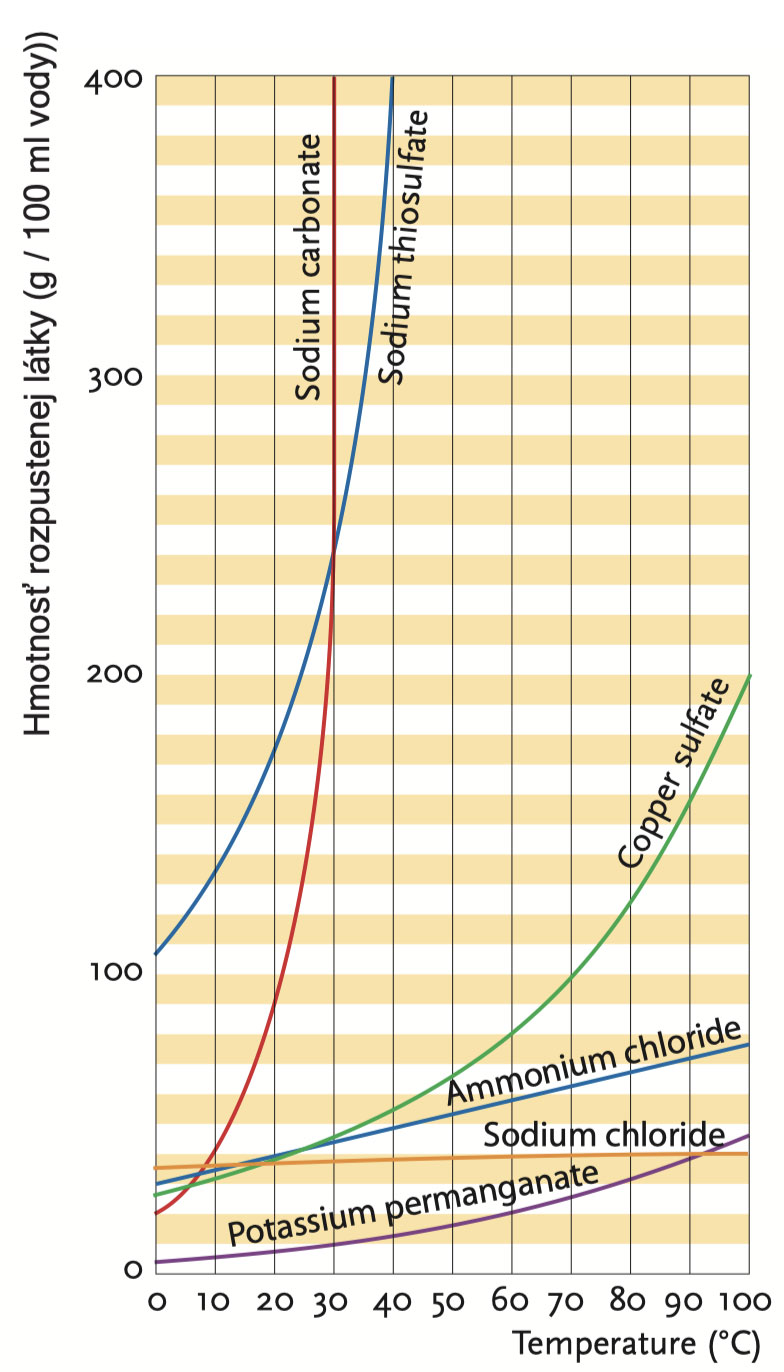
Krivky rozpustnosti niekoľkých solí. 100 ml vody rozpustí 400 g tiosíranu sodného pri 40 °C; keď sa zahreje z 0 na 100 °C, rozpustnosť stolovej soli sa takmer vôbec nezmení.
Oddelovanie kryštalizáciou
V nasledujúcom texte budeme používať pojem kryštalizácia na označenie oddelenia kryštálov z vodných roztokov (na báze vody). Kryštalizácia je užitočným separačným a čistiacim procesom, pretože väčšina nečistôt zostáva rozpustená pôvodnom roztoku alebo „materskom roztoku“, zatiaľ čo látka, ktorá vykryštalizovala, vykazuje vyšší stupeň čistoty. Ako proces čistenia však ponecháme kryštalizáciu profesionálom. Budete vykonávať niekoľko jednoduchých pokusov, aby ste sa dozvedeli o metódach tvorby kryštálov, rovnako ako aj získali nejaké skúsenosti s nasýtenými a nenasýtenými roztokmi.
Pri kryštalizácii z vodných roztokov môžeme rozlišovať tri metódy:
1. Kryštalizácia ochladením horúceho nasýteného roztoku
2. Kryštalizácia redukciou množstva rozpúšťadla (odparenie, var)
3. Kryštalizácia pridaním tretej látky so zmenou pomerov rozpustnosti
Ktorý postup použijete v danom prípade závisí od toho, ako sa zmení rozpustnosť kryštalizovaného materiálu s teplotou. Rozpustnosťou alebo koncentráciou nasýtenia sa rozumie množstvo látky (v gramoch), ktoré sa pri danej teplote rozpustí v 100 ml roztoku. Roztok, ktorý obsahuje také množstvo látky pri daných podmienkach, že už sa látka ďalej nerozpúšťa sa nazýva nasýtený roztok. Roztok, ktorý obsahuje menej látky alebo je schopný viac rozpustiť, sa nazýva nenasýtený roztok.
Kryštalizácia chladením
V prípade chloridu amónneho si prečítajte informácie o „ nebezpečných látkach a zmesiach“ na str. 7-9.
Experiment 30
Do skúmavky vlejte 1 až 2 ml vody a pridajte 2 lyžice chloridu amónneho. Skúmavku uzavrite zátkou a pretrepte. Chlorid amónny sa rozpustí; roztok je nenasýtený. Teraz postupne pridávajte viac chloridu amónneho a po každej lyžici premiešajte. Keď sediment zostane aj po premiešaní, roztok je nasýtený. Skúmavku zahrejte. Sediment sa rozpustí. Takže rozpustnosť chloridu amónneho stúpa so zvyšujúcou sa teplotou.
Skúmavku držte pod studenou tečúcou vodou. Biele kryštály sa z roztoku oddelia a chlorid amónny je späť. A1
Jednoduchý príklad: Ak sa 75 g chloridu amónneho rozpustí v 100 ml vody pri 100 °C, ale iba 35 g pri 20 °C, keď sa roztok ochladí zo 100 °C na 20 ° C, 75 g - 35 g = 40 g látky z nej vykryštalizuje. Pre chlorid amónny je potom správny spôsob kryštalizácie, kryštalizácia chladením.
Keď zahrievanie nepomôže
Experiment 31
Vlejte do skúmavky 5 mg vody a pridajte stolovú soľ, až kým sa nevytvorí sediment, ktorý nezmizne ani po dôkladnom trepaní, čo znamená, že roztok je nasýtený. Skúmavku zahrejte. Sediment zostáva.
Chlorid sodný, hlavná zložka stolovej soli, je látka, ktorej rozpustnosť sa pri zahrievaní sotva zvyšuje. Metóda 1 teda nebude fungovať, ale metódy 2 a 3 budú.
Experiment 32
Nalejte trochu nasýteného roztoku kuchynskej soli do odparovacej misky a nechajte roztok odpočívať na teplom a suchom mieste (misku označte poznámkou „roztok kuchynskej soli“). Rozpúšťadlo - voda sa bude postupne odparovať a zostanú kryštály soli.
V prípade denaturovaného liehu si prečítajte informácie o nebezpečných látkach a zmesiach na str. 7–9.
Požiadajte dospelého aby vám pomohol naliať požadované množstvo alkoholu.
Experiment 33
Z nerozpusteného sedimentu vylejte zvyšok roztoku kuchynskej soli. Pipetou pridajte denaturovaný alkohol. Alkohol nechajte pomaly stekať po stene skúmavky do roztoku stolovej soli. Kde sa soľný roztok a alkohol stretnú, vytvorí sa biely oblak. Skúmavku trochu pretrepte a pozorne sledujte. Z oblaku uvidíte padať malé kryštály. A1
Stolová soľ je v etanole prakticky nerozpustná (hlavná zložka denaturovaného alkoholu). Na hranici, kde sa roztok soli a alkoholu dotýkajú, dochádza k miešaniu oboch kvapalín, čo vedie k poklesu rozpustnosti stolovej soli: Z roztoku sa oddeľuje ďalšia sol.
Oddeľovanie na filtračnom papieri
Pre nasledujúce experimenty bude najskôr potrebné vytvoriť separačnú komoru. Pozrite sa na ilustráciu vpravo a uvidíte, čo musíte urobiť. Vložte malý drôtený háčik (ktorý môžete vyrobiť narovnaním kancelárskej spinky) do kúska korku a pripevnite korok na veko nádoby.
Experiment 34
Dodatočný materiál: Značkovače - fixky
Teraz sa chystáte zorganizovať preteky farieb značkovací pier. Vystrihnite 3 cm široký prúžok filtračného papiera, dostatočne dlhého na to, aby sa pri zavesení na drôtený hák dostal niekoľko milimetrov nad dno nádoby. Pás položte na čistý povrch a nakreslite ceruzkou „štartovaciu čiaru“.
Asi 1 cm od spodného okraja pásu vyznačte fixkami bodky rôznych farieb (priemer bodov by mal byť približne 2 mm ).
Nalejte do nádoby asi pol centimetra vody, zaveste pripravený prúžok na háčik a naskrutkujte veko na nádobu. Ak ste urobili všetko správne, dolný okraj pásu by sa mal ponoriť do vody. Farebné škvrny by ale nemali byť pod vodou.
Teraz sledujte preteky farieb. Niektoré sa pohybujú tak rýchlo ako voda, zatiaľ čo iné sú pomalšie. Najzaujímavejšie zo všetkého je, že budete vedieť, či dané pero obsahuje jednu farbu alebo kombináciu farieb. Fialová je často zmes červenej a modrej , zelená sa môže ukázať ako zmes modrej a žltej . Farby sa oddeľujú na filtračnom papieri. Výsledok tohto druhu separácie je známy ako chromatogram.
Experiment 35
V poslednom experimente voda pôsobila ako rozpúšťadlo , ktoré má v tejto technike špeciálny názov mobilná fáza. Predchádzajúci pokus zopakujte, ale tentokrát použite ako mobilnú fázu zmes 4 ml vody a 3 ml denaturovaného alkoholu. Postrehli ste rozdiel? A1

Poznámky pod čiarou
Od farebných vzorov po papierovú chromatografiu
Experimenty ako tieto, ktoré ste práve vykonali, boli prvýkrát vykonané pred viac ako 150 rokmi. Chemika Friedlieba Ferdinanda Rungea (1794 - 1867) fascinovali farebné reakcie na filtračnom papieri. Pre neho to však bolo menej záležitosťou oddeľovania látok, viac to ponímal ako umenie, pretože svoje štúdie publikoval ako inšpirácie pre ilustrátorov, maliarov a návrhárov tkanín.
Papierová chromatografia ( grécky chromos znamená farba), ktorú vyvinuli anglickí výskumníci počas druhej svetovej vojny (1939 - 1945), slúži na analytické účely. Táto metóda využíva ako mobilnú fázu špeciálne filtračné papiere, ako aj organické rozpúšťadlá alebo zmesi rozpúšťadiel. Vzdialenosti, ktoré prekonávajú skúšané látky, sa určujú spôsobmi, ktorými sa látky delia medzi filtračným papierom obsahujúcim vodu a rozpúšťadlami vystupujúcimi z papiera.
Odvtedy bola papierová chromatografia prekonaná tenkovrstvovou chromatografiou, ktorá namiesto filtračného papiera používa plastové fólie potiahnuté absorpčnými materiálmi. Základný princíp je rovnaký, ale technika tenkej vrstvy je omnoho efektívnejšia ako staršia metóda.


Obrázok 1: Závody farieb fixiek - voda
Obrázok 2: Závody farieb fixiek - zmes vody a alkoholu v pomere 4: 3
Obrázok 3: Či už jednotlivo alebo spoločne, každá farba cestuje určitú vzdialenosť.
Preteky farieb
Experiment 35
Vyberte dve rovnaké farby , ktoré prešli rôzne vzdialenosti. Urobte jednu bodku (Obrázok 3 vyššie) v bode 1 štartovej čiary s farbou A a jednu v bode 3 s farbou B a v bode 2 aplikujte zmes oboch farieb (jedna po druhej). Ako mobilnú fázu použite vodu alebo zmes vody a alkoholu. Kombinované farby (bod 2) sa oddelia a uvidíte, že farebné zložky sa pohybujú presne tak ďaleko, ako sú nezmiešané farby, ktoré sa pohybujú vedľa nich. (bod 1 a 3) A1
Ak máte neznámu zmes, v ktorej je podozrenie na identitu jednej alebo druhej zložky, môžete nechať tieto komponenty bežať vedľa seba a tak na prvý pohľad vidieť, či sú v zmesi prítomné.
Chemické fakty
Chromatogramy poskytujú informácie o rôznych farebných zložkách zmesi látok. Aj bezfarebné látky sa môžu oddeliť, ak sa vyrobia tak, aby produkovali charakteristické farby použitím vhodných činidiel.

