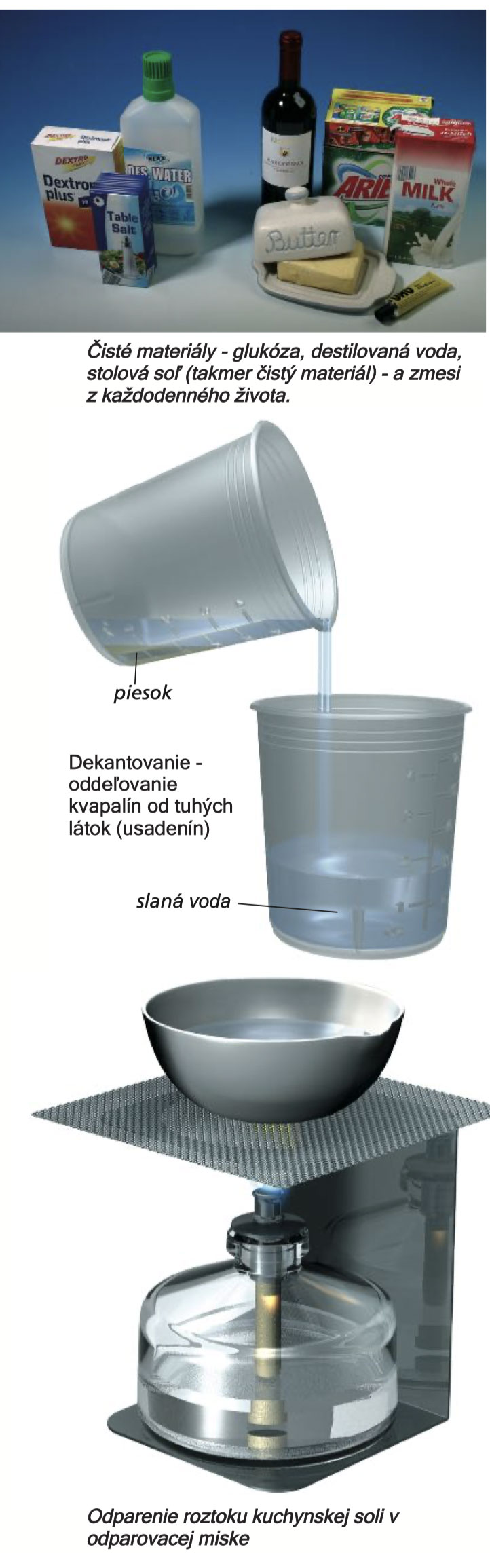
V priebehu času sa chemici snažili zaviesť poriadok v množstve materiálov a látok. Na najvšeobecnejšej úrovni odlišujú čisté látky od zmesí. Čistá látka je taká, ktorá je bez prítomnosti iných materiálov, zatiaľ čo zmes pozostáva z dvoch alebo viacerých zložiek. Naše jedlá sú zmesi. Napríklad med obsahuje veľa rôznych zložiek, ako je glukóza, fruktóza a voda.
Pre zmesi je charakteristické, že ich jednotlivé zložky sú udržiavané v zmesi a zvyčajne je možné ich od seba opäť oddeliť pomocou fyzikálnych metód (pri ktorých nedochádza k chemickej premene).
Látky v zmesi je možné oddeliť
Experiment č.3
Dodatočný materiál: Piesok
V skúmavke premiešajte 5 lyžíc kuchynskej soli s rovnakým množstvom piesku, kým nezískate rovnomernú zmes. Ak máte dobré zväčšovacie sklo alebo mikroskop, môžete jasne rozoznať kryštály soli od zŕn piesku.
Experiment č.4
Zmes pridajte do odmernej kadičky s 50 ml vody a dôkladne ju premiešajte odmernou lyžicou . Piesok sa usadí na dne kadičky.
Opatrne nalejte kvapalinu nad pieskom do druhej odmerky. Keď takto odlejete tekutinu zo sedimentu , nazýva sa to dekantácia . Tento termín sa používa často pri vylievaní dobre vyzretého vína z jeho sedimentu.
Oddelenie zložiek zmesi soľ-piesok závisí od nerovnomernej rozpustnosti zložiek vo vode . Zatiaľ čo sa soľ úplne rozpúšťa, piesok je prakticky nerozpustný. Piesok môžete oddeliť opakovaným premývaním zvyškov soli a následným vysušením. Na získanie soli budete musieť odstrániť rozpúšťadlo - vodu.
Experiment č.5
Nalejte polovicu roztoku kuchynskej soli do odparovacej misky a zohrejte misku na stojane horáka pomocou drôteného pletiva, aby sa teplo šírilo rovnomerne. Nakoniec sa voda pôsobením tepla vyparí a zostane biela kôra: stolová soľ. Odparili ste roztok kuchynskej soli.
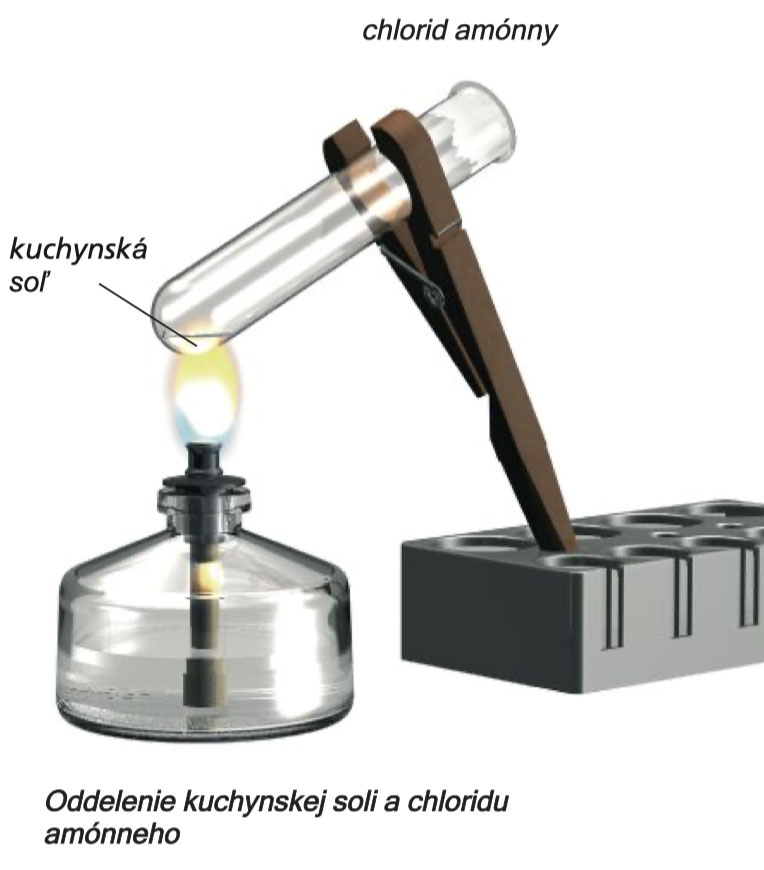
Zložky môžu byť tiež izolované zo zmesi stolovej soli a chloridu amónneho . Nebudete však schopní postupovať ako v experimente 4, pretože obe látky sú rozpustné vo vode. Tu bude užitočná iná separačná metóda.
V prípade chloridu amónneho a hydroxidu vápenatého si prečítajte informácie o nebezpečných látkach a zmesiach na str. 7-9..
Experiment č.6
V suchej skúmavke zohrejte zmes 2 lyžičiek stolovej soli a 2 lyžičiek chloridu amónneho. Vytvorí sa biela hmla. V chladnejšej časti skúmavky v blízkosti otvoru sa na stene skúmavky usadí biely povlak. Vo vyhrievanej časti zostane určitá látka.
Experiment č.7
Odmernou lyžicou zoškrabte zo skúmavky biely povlak a ten potom zahrejte v druhej suchej skúmavke. Biele zoškrabané omrvinky sa odparia bez zanechania zvyškov. Vykonajte kontrolný experiment, aby ste sa presvedčili, že nezmiešaný chlorid amónny sa odparí bez zanechania akéhokoľvek zvyšku (zahrejte 1 malú lyžičku látky v suchej skúmavke). A1 (Metódy likvidácie odpadu A1 – A12 sú opísané na stranách 175–177.)
Existujú látky, ktoré pri zahrievaní prejdú z tuhého stavu rovno do plynného a pri ochladení sa vracajú z plynného skupenstva späť do tuhého stavu. Prvá časť tohto procesu sa nazýva sublimácia a druhá sa nazýva depozícia alebo desublimácia. Pozrite sa na obrázok na str. 30: Prechody medzi jednotlivými stavmi látok. V separačných a čistiacich metódach, ako je tá, ktorú ste práve vykonali, sa sublimácia používa na označenie nielen prvého čiastkového kroku, ale celého procesu: tuhej - plynnej - pevnej látky. Takto vyčistený produkt sa nazýva sublimát.
Keď materiály navzájom reagujú
Experimentujte vonku alebo pri otvorenom okne. Po experimente dobre vetrajte. Dodržiavajte uvedené množstvá.
Čpavok je toxický pri vdýchnutí a spôsobuje vážne poleptanie kože a vážne poškodenie očí. - Nevdychujte plyn. - PO VDÝCHNUTÍ: Presuňte postihnutého na čerstvý vzduch a nechajte ho oddychovať v polohe, ktorá mu umožní pohodlné dýchanie. - PO ZASIAHNUTÍ OČÍ: Niekoľko minút ich opatrne oplachujte vodou. Ak sú prítomné kontaktné šošovky a je možné ich odstránenie, odstráňte ich. Pokračujte v oplachovaní. Okamžite volajte TOXIKOLOGICKÉ INFORMAČNÉ CENTRUM alebo lekára.
Experiment č.8
V odparovacej miske zahrejte 1 lyžicu hydroxidu vápenatého a 1 lyžicu chloridu amónneho. Môžete si všimnúť prenikavý zápach, ktorý nebolo cítiť pri experimentoch 6 a 7. Je to ten istý zápach, ktorý postrehnete, keď otvoríte fľašu roztoku amoniaku. A1
Test čuchom: Opatrne mávnite výpary, ktoré vychádzajú zo skúmavky alebo fľaše smerom k sebe. Nevdychujte ich!

Ako otestovať vôňu chemikálií.
Na rozdiel od predchádzajúcich experimentov sa v experimente 8 uskutočnila premena alebo chemická reakcia. Okrem iného sa z hydroxidu vápenatého a chloridu amónneho vytvoril plynný amoniak. Experiment ukazuje, že čisté látky môžu byť aj kompozíciami iných vecí. Ale zatiaľ čo v zmesi existujú zložky vedľa seba, látky, ktoré sa zúčastňujú chemickej reakcie, sa kombinujú do iných látok s úplne novými vlastnosťami. .
V prípade horčíka si všimnite informácie „Nebezpečné látky a zmesi“ začínajúce na str. 7. Nepozerajte sa do plameňa! Extrémny jas môže poškodiť vaše oči. Vyvarujte sa vdychovaniu výparov z horiaceho horčíka! Po ukončení experimentu dobre vyvetrajte!
Experiment č.9
Dodatočný materiál: Kliešte
Použite kliešte na podržanie pásu horčíka s dĺžkou 2 cm v plameni horáka. Horčík horí intenzívnym svetlom a zmení sa na biely prášok. A1
Aj tu nastala chemická reakcia, ktorá premenila kov horčíka na práškovú látku, ktorá sa podobá na látku, s ktorou ste začínali.
Horčík
Horčík alebo magnézium (lat. Magnesium ; gr. Μαγνησία = názov oblasti v Grécku) je chemický prvok v Periodickej tabuľke prvkov, ktorý má značku Mg a protónové číslo 12. Je to mäkký, ľahký kov, ktorý rýchlo reaguje s kyslíkom i vodou; na vzduchu sa postupne pokryje vrstvou oxidu, ktorá ho chráni pred ďalšou oxidáciou. Takto je možné ho uchovávať pomerne dlhú dobu. Vďaka svojej pomerne veľkej reaktivite sa v prírode horčík vyskytuje len v zlúčeninách.
Klikni sem pre viac detailov
Chemické fakty
Všetky materiály sú rozdelené na prvky, chemické zlúčeniny a zmesi. Prvky už nemožno rozložiť na jednoduchšie látky. Chemické zlúčeniny sa skladajú z dvoch alebo viacerých prvkov a zvyčajne majú úplne odlišné vlastnosti od prvkov, ktoré ich tvoria. V zmesi existujú zložky vedľa seba a neprebieha medzi nimi žiadna chemická reakcia.

Prvky a zlúčeniny
V priebehu svojich výskumov chemici zistili, že existuje relatívne málo látok, ktoré sa nedajú rozdeliť na jednoduchšie. Tieto nedeliteľné látky sa nazývajú prvky. Všetky ostatné látky pochádzajú z kombinácií dvoch alebo viacerých prvkov, a preto sa nazývajú chemické zlúčeniny. Pri zahrievaní sa prvok horčík kombinuje s prvkom kyslík vo vzduchu a vytvára oxid horečnatý. Stolová soľ - alebo v jazyku chemikov chlorid sodný je zlúčenina agresívneho, leptavého, ľahkého kovu sodíka s ostro páchnucim jedovatým chlórom. To je dokonalým príkladom toho, ako môžu mať zlúčeniny úplne odlišné vlastnosti od látok, ktoré obsahujú.
Väčšina prvkov sa vyskytuje veľmi zriedka. V tabuľke sú uvedené hlavne tie prvky, ktoré budete pravdepodobne poznať.
Syntéza a analýza
Pri syntéze oxidu horečnatého v experimente 9 sa zlučili prvky horčíka a kyslíka. Ale syntéza tiež nastáva, keď namiesto samotných prvkov reagujú navzájom zlúčeniny alebo časti zlúčenín. V nasledujúcom experimente budete syntetizovať zlúčeninu síranu meďnatého z prvku medi a zlúčeniny hydrogén-síranu sodného. Budete tiež vytvárať ostro zapáchajúci plyn: oxid siričitý.
Vykonajte experiment vonku alebo pri otvorenom okne. Po experimente dobre vyvetrajte. Dodržiavajte uvedené množstvá.
Oxid siričitý je toxický pri vdýchnutí, spôsobuje vážne poleptanie kože a poškodenie očí. - Nevdychujte plyn. - PO VDÝCHNUTÍ: Presuňte postihnutého na čerstvý vzduch a nechajte ho oddychovať v polohe, ktorá mu umožní pohodlné dýchanie.- PO ZASIAHNUTÍ OČÍ: Opatrne niekoľko minút oplachujte vodou. Ak sú prítomné kontaktné šošovky a je možné ich odstrániť, odstráňte ich. Pokračujte v oplachovaní. - Okamžite volajte TOXIKOLOGICKÉ INFORMAČNÉ CENTRUM alebo lekára.
Experiment č.10
V suchej skúmavke zahrejte kus medeného pliešku veľkosti 1 x 1 cm, ktorý nájdete v súprave, spolu s 2 lyžičkami hydrogén-síranu sodného. Skúmavku upnite do držiaku v miernom sklone s otvoreným koncom nadol tak, aby z nej mohla vytiecť kvapalina, ktorá sa môže vytvoriť (zachyťte ju do odmernej kadičky). Síran sodný sa roztopí a vodná para unikne. Po niekoľkých minútach produkcia pary ustúpi a obsah skúmavky sa zmení na zelený alebo modrasto-zelený a môžete si všimnúť ostrý zápach plynu. Potom, čo sa skúmavka ochladí, pridajte do nej 10 ml vody a zahrejte (použite varnú tyčinku!). Roztopená hmota sa rozpustí a vytvorí sa svetlomodrý roztok.
Môže v ňom byť ešte niekoľko zvyškov medi. Budete potrebovať tento roztok pre Experimenty 11 a 13.
Vytvorili ste roztok síranu meďnatého. Kovová meď bola väčšinou rozpustená hydrogénsíranom sodným. V tomto procese sa meď spája so „ sulfátovou“ zložkou. Táto zložka obsahuje prvky síry a kyslíka, o ktorých sa dozviete viac v kapitole 15
Po syntéze prichádza analýza. Nebudete úplne rozkladať síran meďnatý na jeho prvky - meď, síru a kyslík - ale budete získavať rozpustenú meď z modrého roztoku.
V prípade železných pilín si preštudujte informácie o nebezpečných látkach a zmesiach na str. 7–9. Keď pretrepávate skúmavku, vždy držte palec nad zátkou, aby nedošlo k jej uvoľneniu!
Experiment č.11
Polovicu roztoku síranu meďnatého (z experimentu 10) umiestnite do skúmavky a pridajte 1 lyžicu železných pilín. Skúmavku uzavrite zátkou a chvíľu energicky pretrepávajte.
Pozrite sa na obsah skúmavky! Železné piliny sú pokryté červeným medeným povlakom. Môžete tiež do roztoku umiestniť lesklý železný klinec. V kapitole 13 zistíte, prečo sa meď z roztoku obsahujúceho meď, uloží na železo. Roztok: A1, kov: A3
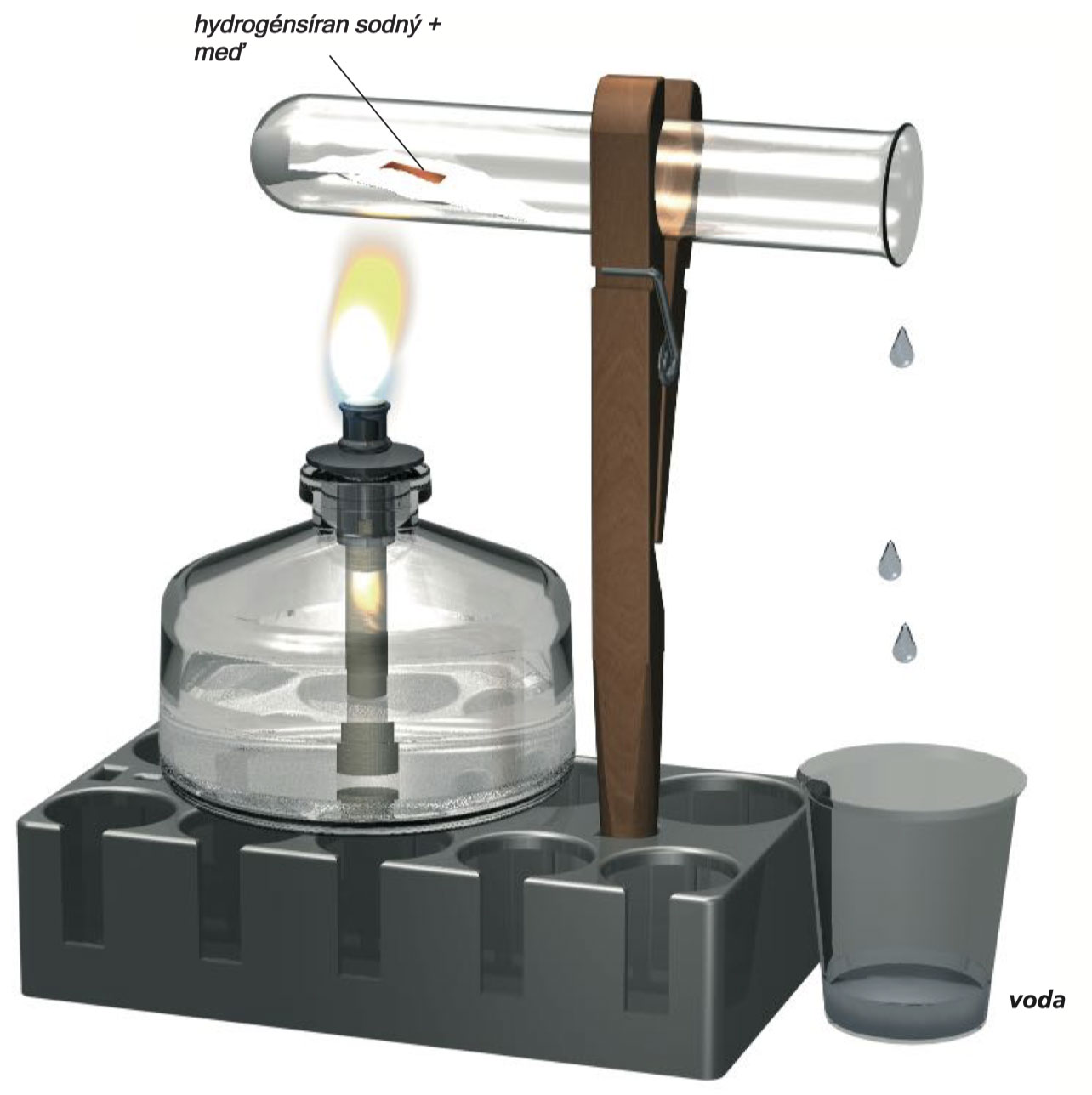
Syntéza síranu meďnatého z medi a hydrogénsíranu sodného
Pri pretrepávaní skúmavky vždy držte palec na zátke!
Experiment č.12
Experiment opakujte s roztokom síranu meďnatého vyrobeného zo síranu meďnatého, ktorý je súčasťou súpravy: 1 lyžicu modrých kryštálov rozpustite v 5 ml vody.
A1, A3
Ako testujú látky profíci
V praxi je zriedkavé, že analýza zahŕňa úplné rozloženie materiálu alebo zmesi materiálov na jeho súčasti. Častejšie jej úlohou jednoducho odhaliť alebo otestovať určitú zlúčeninu alebo určitý prvok v skúmanej látke. Na to chemici využívajú iné materiály, tzv. reagenty (z latiny pre „reagujú“), ktoré sa prejavujú charakteristickými reakciami s hľadaným materiálom - výskyt charakteristického zápachu, určitej farby, či usadeniny alebo zákalu. Takže v roztoku nemusíte oddeľovať kovovú meď od železa. Na jeho zistenie môžete použiť aj vhodné činidlo, napríklad roztok amoniaku.
V prípade roztoku amoniaku, síranu železnatého amónneho a síranu meďnatého si prečítajte informácie o nebezpečných látkach a zmesiach na str. 7-9.
Experiment č.13
Do zvyšku roztoku síranu meďnatého, ktorý ste pripravili v experimente 10, pridajte trochu roztoku amoniaku. Vytvorí sa modro-zelený zákal, ktorý sa bude rozpúšťať do tmavo modrej farby, keď pridáte viac amoniaku. S touto reakciou sa opäť stretnete v kapitole 18. A5
Príprava roztoku hexakyanoželezitanu draselného (II)
Hexakyanoželezitan draselný je škodlivý pre vodné organizmy s dlhodobým účinkom, takže by ste mali dať pozor, aby sa čo najmenšie množstvo dostalo do kanalizácie. Ich likvidácia je v bežných podmienkach náročná, preto s týmito látkami zaobchádzajte opatrne.
Rozpustite 2 lyžice ferokyanidu draselného (II)v 15 ml vody a uchovajte roztok v čistej fľaši označenej ako "roztok ferokyanidu draselného (II) ." Potom jednoducho z flaše odoberte potrebné množstvo (obvykle stačí niekoľko kvapiek).
Týmto spôsobom nebudete musieť pripravovať nový roztok a látkou budete menej plytvať.
Predtým, ako zbytky roztoku vylejete do odtoku, mali by sa do nich pridať reakčné produkty (najmä pruskú modrú, uhličitan sodný alebo prášok na pranie.)
Experiment č.14
Predchádzajúci pokus zopakujte s roztokom síranu meďnatého pripraveným rozpustením 1 špičky lyžice síranu meďnatého v 5 ml vody. A5
Všestranné činidlo...
… je hexakyanoželezitan draselný (II), ktorý reaguje s charakteristicky sfarbenými zrazeninami na rôzne kovové zlúčeniny . Najčastejšie sa používa ako test na prítomnosť železa.
Experiment č.15
1 malú lyžičku síranu železitého amónneho(III) rozpustite v skúmavke s 5 ml vody. Použite pipetu na pridanie roztoku hexakyanoželezitanu draselného (II), pripraveného podľa návodu (v modrom štvorci vpravo), po kvapkách do roztoku síranu amónneho železitého. Vytvorí sa tmavomodrý hexakyanoželezitan železitý(II), známy ako pruská modrá. Použitie rímskych číslic v chemických názvoch je vysvetlené v kapitole 12. A1

Železný klinec v roztoku hexakyanoželezitanu draselného (II) pred a po pridaní kyseliny.
Nebojte sa chemických názvov
Už ste spoznali niekoľko chemických názvov: chlorid amónny, hydroxid vápenatý, síran meďnatý, hydrogénsíran sodný a teraz hexakyanoželezitan draselný(II) a síran amónny železitý.
Nemohli chemici vymyslieť ľahšie mená ?
Samozrejme, veľa látok s takými názvami má tiež všeobecný názov, ako je napríklad sóda namiesto uhličitanu sodného alebo sadra namiesto síranu vápenatého. Ale červená krvná soľ je pre vás rovnako „cudzím jazykom“ ako hexakyanoželezitan draselný (II). Akonáhle sa dostanete na koniec tejto knihy budete pravdepodobne používať tieto názvy bez problémov.
Vedecké názvy majú tú výhodu, že skúsený chemik môže okamžite rozpoznať, z čoho sa materiál skladá. Ľudové mená s najväčšou pravdepodobnosťou hovoria o tom, odkiaľ pochádzajú alebo ako boli vytvorené.
Experiment č.16
Do 2cm roztoku hexakyanoferátu draselného (II) pridajte v skúmavke 1 malú lyžicu železných pilín. Tentokrát neuvidíte žiadnu modrú farbu.
V prípade kyseliny chlorovodíkovej si prečítajte informácie o nebezpečných látkach a zmesiach na str. 7-9.
Experiment č.17
Do skúmavky z experimentu 16, pridajte ďalšie 2 ml kyseliny chlorovodíkovej. Klinec sa prekryje modrým povlakom a roztok tiež postupne zmodrá. A2
Hexakyanoželezitan draselný (II) reaguje iba s rozpusteným železom. To platí aj pre väčšinu činidiel. V experimente 17 sa železo pôsobením kyseliny chlorovodíkovej postupne rozpustilo, takže sa vytvorila pruská modrá.
Chemické fakty
Pre väčšinu testovacích reakcií musia byť látky prítomné v rozpustenej forme.
Už na začiatku sme poukázali na to, že chemikálie použité pri analýze musia byť čo najčistejšie. To platí aj pre kyselinu chlorovodíkovú použitú v predchádzajúcom experimente. Môžete použiť kontrolný experiment, aby ste sa uistili, že kyselina chlorovodíková tiež neobsahuje železo. Pre produkty nižšej kvality (tzv. „Technické“) to určite platí.
Experiment č.8
1 ml kyseliny chlorovodíkovej zrieďte v skúmavke trojnásobným množstvom vody a pridajte niekoľko kvapiek roztoku hexakyanoželezitanu draselného (II). Nemali by ste vidieť žiadnu modrú farbu. A2
Predstavujeme chemické prvky
Horčík sa už predstavil. V každej kapitole sa stretnete s novým prvkom a v kapitole 9 dokonca so štyrmi. Sú systematicky organizované v „periodickej tabuľke prvkov“, napríklad podľa podobných vlastností. V periodickej tabuľke vytlačenej na str. 179, uvidíte prázdne štvorce. Predstavujú prvky, ktoré vám v tomto návode predstavíme, pretože s nimi budete pracovať. Na hárku s nálepkami uvidíte „ identifikačnú značku“ vytlačenú pre každý z prvkov, ktorá bude vyzerať presne ako značka, ktorú vidíte periodickej tabulke na strane 179.. Prilepte tieto štítky na prázdne štvorčeky. Číslo pred symbolom prvku, atómové číslo (ktoré je v prípade horčíka 12), vám pomôže pri určení správneho umiestnenia. Plagát s úplnou periodickou tabuľkou nájdete na stranách 182/183.
