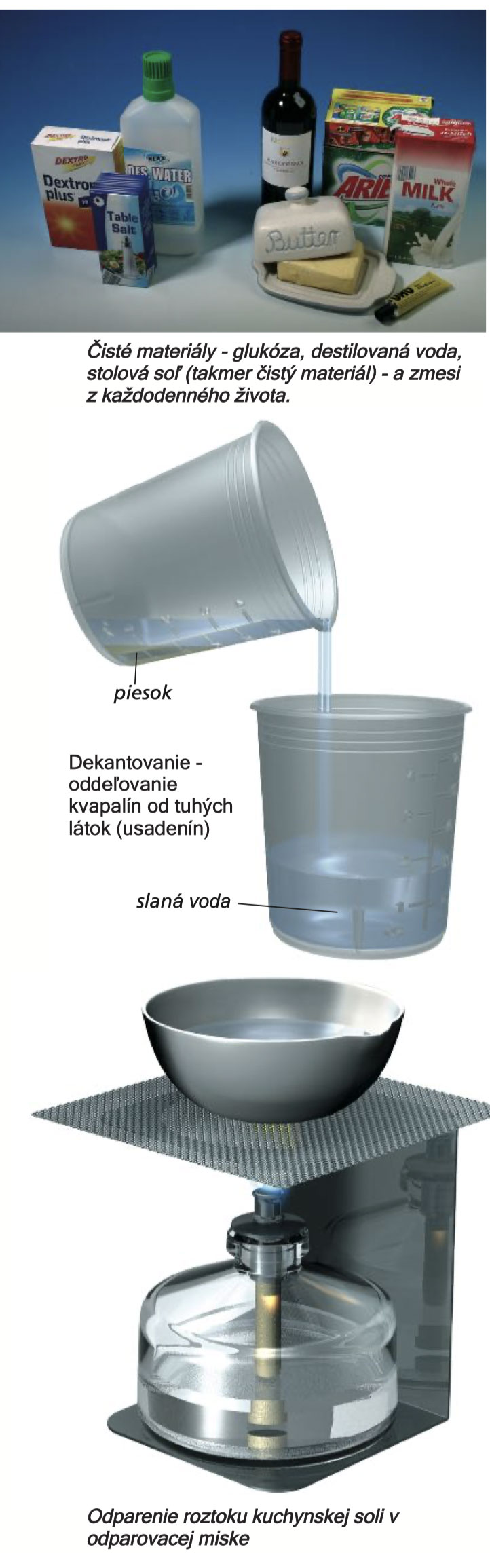
V průběhu času se chemici snažili zavést pořádek v množství materiálů a látek. Na nejobecnější úrovni odlišují čisté látky od směsí. Čistá látka je látka bez přítomnosti jiných materiálů, zatímco směs sestává ze dvou nebo více složek. Naše jídla jsou směsi. Například med obsahuje mnoho různých složek, jako je glukóza, fruktóza a voda.
Pro směsi je charakteristické, že jejich jednotlivé složky jsou udržovány ve směsi a obvykle je možné je od sebe opět oddělit pomocí fyzikálních metod (při kterých nedochází k chemické přeměně).
Látky ve směsi je možné oddělit
Experiment 3
Dodatečný materiál: písek
Ve zkumavce promíchejte 5 lžic kuchyňské soli se stejným množstvím písku, dokud nezískáte rovnoměrnou směs. Pokud máte dobré zvětšovací sklo nebo mikroskop, můžete jasně rozeznat krystaly soli od zrn písku.
Experiment 4
Směs přidejte do odměrné kádinky s 50 ml vody a důkladně ji promíchejte odměrnou lžící. Písek se usadí na dně kádinky.
Opatrně nalijte kapalinu nad pískem do druhé odměrky. Proces, kdy takto odlijte tekutinu ze sedimentu, se nazývá dekantace. Tento termín se používá často při vylévání dobře vyzrálého vína z jeho sedimentu.
Oddělení složek směsi sůl-písek závisí na nerovnoměrné rozpustnosti složek ve vodě. Zatímco se sůl zcela rozpouští, písek je prakticky nerozpustný. Písek můžete oddělit opakovaným promýváním zbytků soli a následným vysušením. Pro získání soli budete muset odstranit rozpouštědlo, tedy vodu.
Experiment 5
Nalijte polovinu roztoku kuchyňské soli do odpařovací misky a zahřejte misku na stojanu hořáku za použití drátěného pletiva, aby se teplo šířilo rovnoměrně. Nakonec se voda působením tepla vypaří a zůstane bílý škraloup: stolní sůl. Odpařili jste roztok kuchyňské soli.
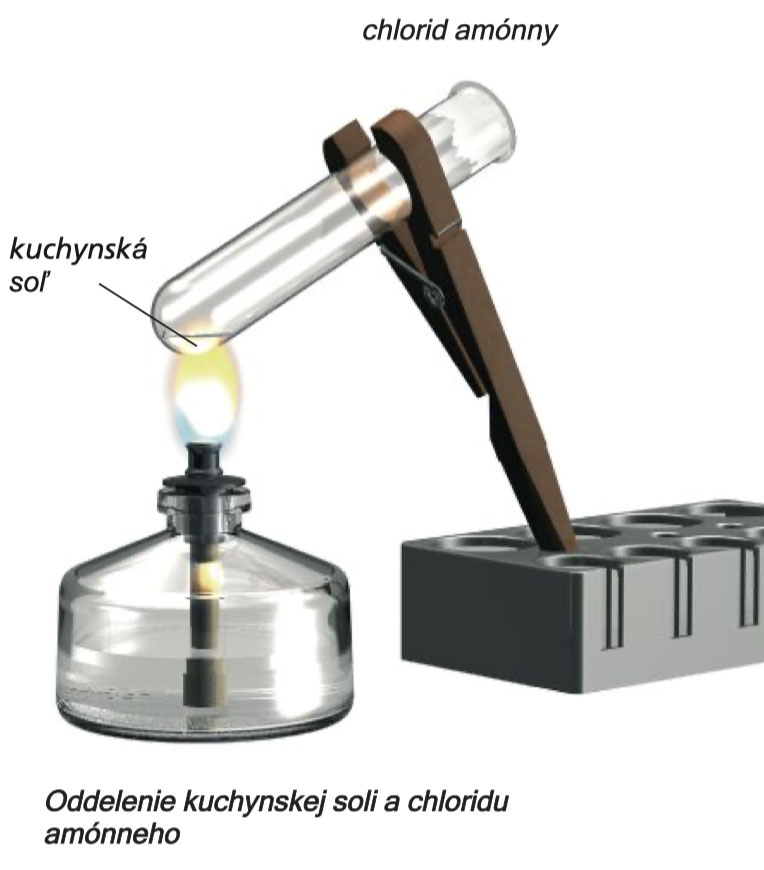
Složky mohou být také izolovány ze směsi stolní soli a chloridu amonného. Nebudete však schopni postupovat jako v experimentu 4, protože obě látky jsou rozpustné ve vodě. Zde bude užitečná jiná separační metoda.
V případě chloridu amonného a hydroxidu vápenatého si pozorně přečtěte informace o nebezpečných látkách a směsích na str. 7-9.
Experiment 6
V suché zkumavce zahřejte směs 2 lžiček stolní soli a 2 lžiček chloridu amonného. Vytvoří se bílá mlha. V chladnější části zkumavky, v blízkosti jejího otvoru se na stěně usadí bílý povlak. V zahřáté části zůstane určitá látka.
Experiment 7
Odměrnou lžící seškrábejte ze zkumavky bílý povlak a ten pak zahřejte v druhé suché zkumavce. Bílé seškrábané drobky se odpaří bez zanechání zbytků. Proveďte kontrolní experiment, abyste se přesvědčili, že nesmíšený chlorid amonný se odpaří bez zanechání jakéhokoliv zbytku (zahřejte 1 malou lžičku látky v suché zkumavce). A1 (Metody odstraňování A1 - A12 jsou popsány na stranách 175-177.)
Existují látky, které při zahřívání přejdou z tuhého stavu rovnou do plynného a při ochlazení se vracejí z plynného skupenství zpět do tuhého stavu. První část tohoto procesu se nazývá sublimace a druhá se nazývá depozice nebo desublimace. Podívejte se na obrázek na str. 30: Přechody mezi jednotlivými stavy látek. V separačních a čisticích metodách jako je ta, kterou jste právě provedli, se sublimace používá k označení nejen prvního dílčího kroku, ale celého procesu: pevná - plynná - pevná látka. Takto vyčištěný produkt se nazývá sublimát.
Když materiály navzájem reagují
Experimentujte venku nebo při otevřeném okně. Po experimentu dobře větrejte. Dodržujte uvedená množství surovin.
Čpavek je toxický při vdechování a způsobuje vážné poleptání kůže a vážné poškození očí. - Nevdechujte plyn. - PŘI VDECHNUTÍ: Přeneste postiženého na čerstvý vzduch a ponechte jej v klidu v poloze, která mu umožní pohodlné dýchání. - PO ZASAŽENÍ OČÍ: Několik minut opatrně vyplachujte vodou. Pokud máte kontaktní čočky a je možné jejich odstranění, odstraňte je. Pokračujte v oplachování. Okamžitě volejte TOXIKOLOGICKÉ INFORMAČNÍ STŘEDISKO nebo lékaře.
Experiment 8
V odpařovací misce zahřejte 1 lžíci hydroxidu vápenatého a 1 lžíci chloridu amonného. Můžete si všimnout pronikavého zápachu, který nebylo cítit při experimentech 6 a 7. Je to tentýž zápach, jenž postřehnete, když otevřete láhev roztoku amoniaku. A1
Test čichem: Opatrně přivějte výpary, které vycházejí ze zkumavky nebo láhve, směrem k sobě. Nevdechujte je!

Jak otestovat vůni chemikálií.
Na rozdíl od předchozích experimentů se v experimentu 8 uskutečnila přeměna neboli chemická reakce. Mimo jiné se z hydroxidu vápenatého a chloridu amonného vytvořil plynný amoniak. Experiment ukazuje, že čisté látky mohou být i kompozicemi jiných věcí. Ale zatímco ve směsi existují složky vedle sebe, látky, které se účastní chemické reakce, se kombinují do jiných látek s úplně novými vlastnostmi. .
V případě hořčíku si všimněte informace "Nebezpečné látky a směsi", začínající na str. 7. Nedívejte se do plamene! Extrémní jas může poškodit vaše oči. Vyvarujte se vdechování výparů z hořícího hořčíku! Po ukončení experimentu dobře vyvětrejte!
Experiment 9
Dodatečný materiál: kleště
Použijte kleště na přidržení pásku hořčíku o délce 2 cm v plameni hořáku. Hořčík hoří intenzivním světlem a změní se na bílý prášek. A1
I zde nastala chemická reakce, která proměnila kov hořčíku na prášek, jenž se podobá látce, se kterou jste začínali.
Hořčík
Hořčík nebo magnézium (lat. Magnesium; gr. Μαγνησία = název oblasti v Řecku) je chemický prvek v periodické tabulce prvků, který má značku Mg a atomové číslo 12. Je to měkký, lehký kov, jenž rychle reaguje s kyslíkem i vodou; na vzduchu se postupně pokryje vrstvou oxidu, která ho chrání před další oxidací. Takto je možné ho uchovávat poměrně dlouhou dobu. Díky své poměrně velké reaktivitě se v přírodě hořčík vyskytuje pouze ve sloučeninách.
Klikni pro více detailů
Chemická fakta
Veškeré materiály dělíme na prvky, chemické sloučeniny a směsi. Prvky už nelze dále rozložit na jednodušší látky. Chemické sloučeniny se skládají ze dvou nebo více prvků a obvykle mají zcela odlišné vlastnosti od prvků, které je tvoří. Ve směsi existují složky vedle sebe a neprobíhá mezi nimi žádná chemická reakce.

Prvky a sloučeniny
Při svých výzkumech chemici zjistili, že existuje relativně málo látek, které nelze rozdělit na jednodušší. Tyto nedělitelné látky se nazývají prvky. Všechny ostatní látky pocházejí z kombinací dvou nebo více prvků, a proto se nazývají chemické sloučeniny. Při zahřívání se prvek hořčík kombinuje s prvkem kyslík ve vzduchu a vytváří oxid hořečnatý. Kuchyňská sůl neboli v jazyce chemiků chlorid sodný je sloučenina agresivního, leptavého, lehkého kovu sodíku s ostře páchnoucím jedovatým chlórem. Je dokonalým příkladem toho, jak mohou mít sloučeniny zcela odlišné vlastnosti od látek, které obsahují.
Většina prvků se vyskytuje velmi zřídka. V tabulce jsou uvedeny hlavně ty, které budete pravděpodobně znát.
Syntéza a analýza
Při syntéze oxidu hořečnatého v experimentu 9 se sloučily prvky hořčík a kyslík. Ale syntéza také nastává, když místo samotných prvků reagují navzájem sloučeniny nebo části sloučenin. V následujícím experimentu budete syntetizovat sloučeninu síranu měďnatého z prvku mědi a sloučeniny hydrogensíranu sodného. Budete také produkovat ostře zapáchající plyn: oxid siřičitý.
Proveďte experiment venku nebo při otevřeném okně. Po experimentu dobře vyvětrejte. Dodržujte uvedená množství.
Oxid siřičitý je toxický při vdechování, způsobuje těžké poleptání kůže a poškození očí. - Nevdechujte plyn. - PŘI VDECHNUTÍ: Přeneste postiženého na čerstvý vzduch a ponechte jej v klidu v poloze, která mu umožní pohodlné dýchání.- PŘI ZASAŽENÍ OČÍ: Několik minut opatrně vyplachujte vodou. Pokud máte kontaktní čočky a lze je odstranit, odstraňte je. Pokračujte v oplachování. - Okamžitě volejte TOXIKOLOGICKÉ INFORMAČNÍ STŘEDISKO nebo lékaře.
Experiment 10
V suché zkumavce zahřejte kus měděného plíšku velikosti 1 x 1 cm, který najdete v soupravě, spolu se 2 lžičkami hydrogensíranu sodného. Zkumavku upněte do držáku v mírném sklonu s otevřeným koncem dolů tak, aby z ní mohla vytéct kapalina, která se může vytvořit (zachyťte ji do odměrné kádinky). Síran sodný roztaje a vodní pára unikne. Po několika minutách produkce páry ustoupí a obsah zkumavky se změní na zelený nebo modravě zelený a můžete si všimnout ostrého zápachu plynu. Poté, co se zkumavka ochladí, přidejte do ní 10 ml vody a zahřejte (použijte varnou tyčinku!). Zkondenzovaná hmota se rozpustí a vytvoří se světle modrý roztok.
Může v něm být ještě několik zbytků mědi. Tento roztok budete potřebovat pro experimenty 11 a 13.
Vytvořili jste roztok síranu měďnatého. Kovová měď byla většinou rozpuštěna v hydrogensíranu sodném. V tomto procesu se měď spojuje se "sulfátovou" složkou. Tato složka obsahuje prvky síry a kyslíku, o kterých se dozvíte více v kapitole 15.
Po syntéze přichází analýza. Nebudete zcela rozkládat síran měďnatý na jeho prvky - měď, síru a kyslík, ale budete získávat rozpuštěnou měď z modrého roztoku.
V případě železných pilin si prostudujte informace o nebezpečných látkách a směsích na str. 7-9. Při protřepávání obsahu zkumavky vždy držte palec na zátce, aby nedošlo k jejímu uvolnění!
Experiment 11
Polovinu roztoku síranu měďnatého (z experimentu 10) dejte do zkumavky a přidejte 1 lžíci železných pilin. Zkumavku uzavřete zátkou a chvíli energicky protřepávajte.
Podívejte se na obsah zkumavky! Železné piliny jsou pokryty červeným měděným povlakem. Můžete také do roztoku umístit lesklý železný hřebík. V kapitole 13 zjistíte, proč se měď z roztoku obsahujícího měď, uloží na železo. Roztok: A1, kov: A3
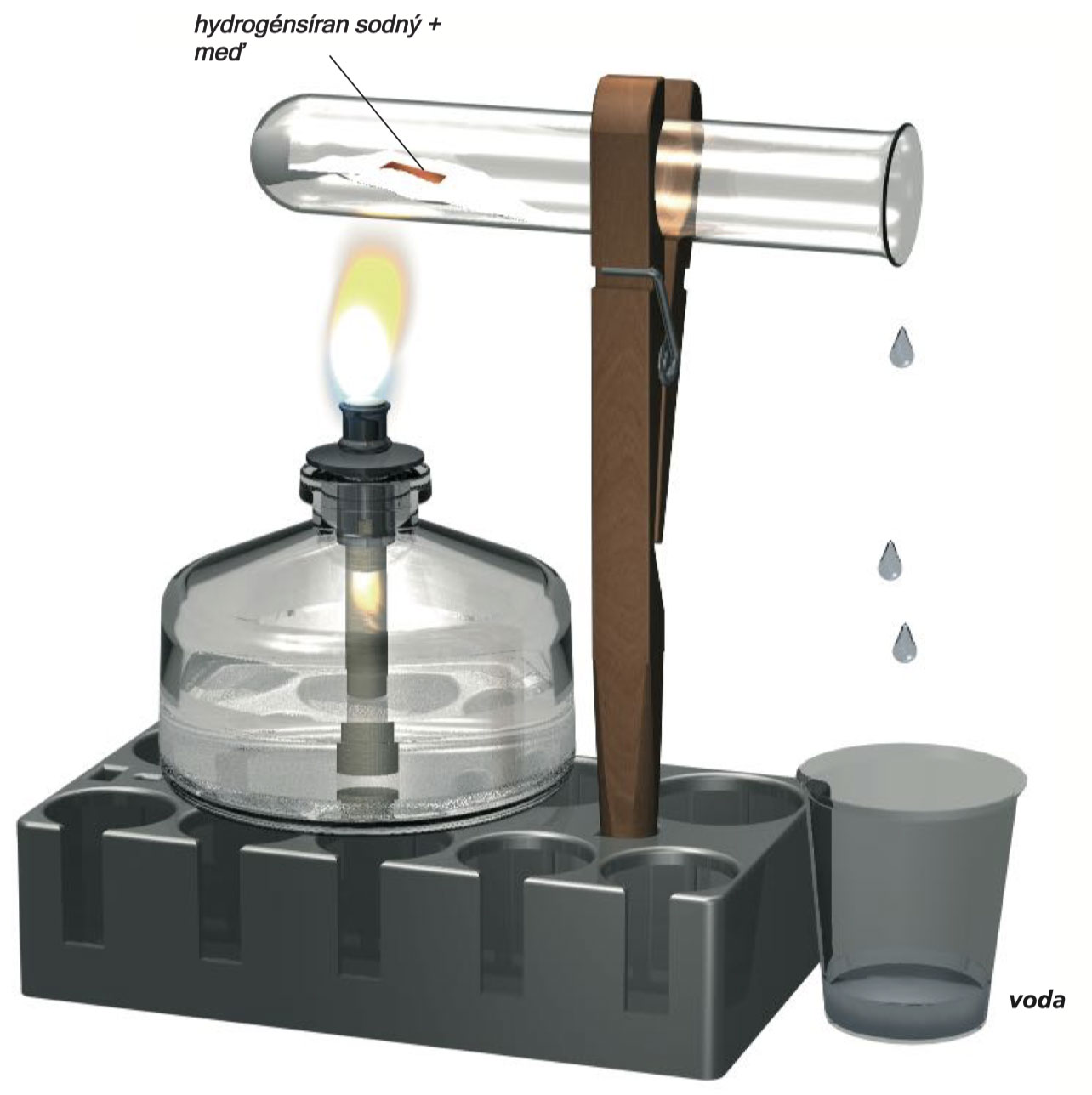
Syntéza síranu měďnatého z mědi a hydrogensíranu sodného.
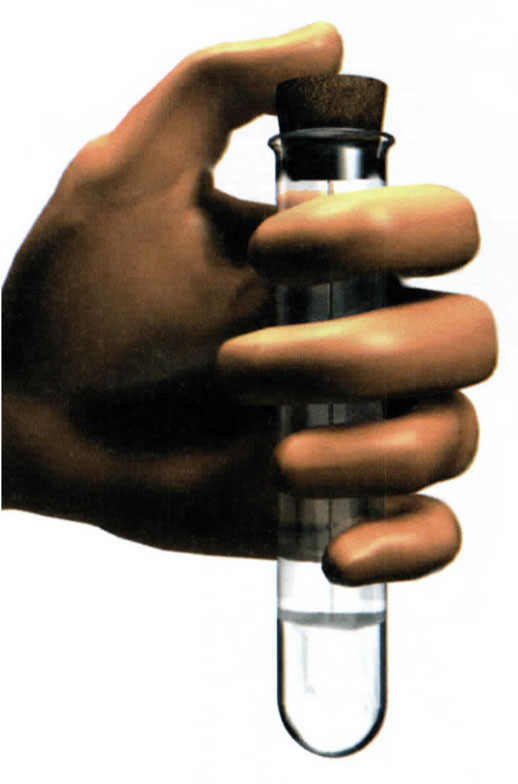
Při protřepávání zkumavky vždy držte palec na zátce!
Experiment 12
Experiment opakujte s roztokem síranu měďnatého vyrobeného ze síranu měďnatého, který je součástí soupravy: 1 lžíci modrých krystalů rozpusťte v 5 ml vody.
A1, A3
Jak testují látky profíci
V praxi je vzácné, že analýza zahrnuje úplné rozložení materiálu nebo směsi materiálů na jeho složky. Častěji je jejím úkolem jednoduše odhalit nebo otestovat určitou sloučeninu či prvek ve zkoumané látce. K tomu chemici používají jiné materiály, tzv. činidla (reagencie; z latiny pro "reagovat"), které se projevují charakteristickými reakcemi s hledaným materiálem - výskyt charakteristického zápachu, určité barvy, usazeniny nebo zákalu. Takže v roztoku nemusíte oddělovat kovovou měď od železa. Ke zjištění jeho přítomnosti lze použít také vhodné činidlo, například roztok amoniaku.
V případě roztoku amoniaku, síranu amonno-železitého a síranu měďnatého si pozorně přečtěte informace o nebezpečných látkách a směsích na str. 7-9.
Experiment 13
Do zbytku roztoku síranu měďnatého, který jste připravili v experimentu 10, přidejte trochu roztoku amoniaku. Vznikne modro-zelený zákal, který se bude rozpouštět do tmavě modré barvy, když přidáte více amoniaku. S touto reakcí se opět setkáte v kapitole 18. A5
Příprava roztoku hexakyanoželeznatanu draselného (II)
Hexakyanoželeznatan draselný je škodlivý pro vodní organismy s dlouhodobým účinkem, takže byste měli dát pozor, aby se ho do kanalizace dostalo co možná nejmenší množství. Jeho likvidace je v běžných podmínkách náročná, proto s takovými látkami zacházejte opatrně.
Rozpusťte 2 lžíce hexakyanoželeznatanu draselného (II) v 15 ml vody a uchovejte roztok v čisté láhvi označené jako "roztok hexakyanoželeznatanu draselného (II)." Pak jednoduše z láhve odeberte potřebné množství (obvykle stačí několik kapek).
Tak nebudete muset připravovat nový roztok a látkou budete méně plýtvat.
Než zbytky roztoku vylijete do odtoku, měli byste do něj přidat reakční produkty (zejména pruskou modř, uhličitan sodný nebo prášek na praní).
Experiment 14
Předchozí pokus opakujte s roztokem síranu měďnatého připraveným rozpuštěním 1 špičky lžíce síranu měďnatého v 5 ml vody. A5
Všestranné činidlo...
... je hexakyanoželeznatan draselný (II), který reaguje s charakteristicky zbarvenými sraženinami na různé kovové sloučeniny. Nejčastěji se používá jako test na přítomnost železa.
Experiment 15
1 malou lžičku síranu amonno-železitého rozpusťte ve zkumavce s 5 ml vody. Použijte pipetu na přidání roztoku hexakyanoželeznatanu draselného (II), připraveného podle návodu (v modrém čtverci vpravo), po kapkách do roztoku síranu amonno-železitého. Vznikne tmavě modrý hexakyanoželeznatan železitý (iron(III) hexacyanoferrate(II)), známý jako pruská modř. Používání římských číslic v chemických názvech je vysvětleno v kapitole 12. A1

Železný hřebík v roztoku hexakyanoželeznatanu draselného před a po přidání kyseliny.
Nebojte se chemických názvů
Už jste poznali několik chemických názvů: chlorid amonný, hydroxid vápenatý, síran měďnatý, hydrogensíran sodný a nyní hexakyanoželeznatan draselný (II) a síran amonno-železitý.
Nemohli chemici vymyslet snadnější jména?
Samozřejmě, mnoho látek s takovými názvy má také obecný název, jako je například soda namísto uhličitanu sodného nebo sádra namísto síranu vápenatého. Ale červená krevní sůl je pro vás stejně "cizím jazykem" jako hexakyanoželeznatan draselný (II). Jakmile se dostanete na konec této příručky, budete pravděpodobně používat tyto názvy bez problémů.
Vědecké názvy mají tu výhodu, že zkušený chemik může okamžitě rozpoznat, z čeho se materiál skládá. Lidové názvy s největší pravděpodobností hovoří o tom, odkud látky pocházejí nebo jak byly vytvořeny.
Experiment 16
Do 2 cm roztoku hexakyanoželeznatanu draselného (II) přidejte do zkumavky 1 malou lžíci železných pilin. Tentokrát neuvidíte žádnou modrou barvu.
V případě kyseliny chlorovodíkové si pozorně přečtěte informace o nebezpečných látkách a směsích na str. 7-9.
Experiment 17
Do zkumavky z experimentu 16 přidejte další 2 ml kyseliny chlorovodíkové. Hřebík se pokryje modrým povlakem a roztok také postupně zmodrá. A2
Hexakyanoželeznatan draselný (II) reaguje pouze s rozpuštěným železem. To platí i pro většinu činidel. V experimentu 17 se železo působením kyseliny chlorovodíkové postupně rozpustilo, takže vznikla pruská modř.
Chemická fakta
Pro většinu testovacích reakcí musí být látky přítomny v rozpuštěné formě.
Už na začátku jsme poukázali na to, že chemikálie použité při analýze musí být co nejčistší. To platí i pro kyselinu chlorovodíkovou použitou v předchozím experimentu. Můžete udělat kontrolní experiment, abyste se ujistili, že kyselina chlorovodíková také neobsahuje železo. Pro produkty nižší kvality (tzv. "technické") to určitě platí.
Experiment 18
1 ml kyseliny chlorovodíkové zřeďte ve zkumavce trojnásobným množstvím vody a přidejte několik kapek roztoku hexakyanoželeznatanu draselného (II). Neměli byste vidět žádnou modrou barvu. A2
Představujeme chemické prvky
Hořčík se už představil. V každé kapitole se setkáte s novým prvkem a v kapitole 9 dokonce se čtyřmi. Jsou systematicky organizovány v "periodické tabulce prvků", například podle podobných vlastností. V periodické tabulce na str. 179 uvidíte prázdné čtverce. Zastupují prvky, které vám v tomto návodu představíme, protože s nimi budete pracovat. Na archu s nálepkami uvidíte "identifikační značku" vytištěnou pro každý z prvků, která bude vypadat přesně jako značka, kterou vidíte v periodické tabulce na straně 179 . Přilepte tyto štítky do prázdných čtverečků. Číslo před symbolem prvku, atomové číslo (které je v případě hořčíku 12), vám pomůže při určení správného umístění. Plakát s úplnou periodickou tabulkou prvků najdete na stranách 182/183.
