Voda je nejdůležitějším rozpouštědlem, a to nejen chemických činidel, ale především mnoha tisíců materiálů uplatňujících se v biochemických procesech v živých organismech.
Vodu můžeme v jistém smyslu považovat za "potravinu", takže musí být čistá a nesmí obsahovat žádné zdraví škodlivé látky. Faktem však je, že znečištění našeho životního prostředí neušetřilo ani vodu. Jsou známy mnohé problémy způsobené znečištěním škodlivými látkami, z nichž některé jsou legální a jiné zas ne, které se dostávají do potoků, řek a jezer nebo do tzv. povrchových vod.
V tomto kontextu je však důležité, že hladina podzemní vody klesá v důsledku jiných zásahů do přírody (např. vlivem terénních úprav, odlesňováním či odumíráním lesů), což má za následek nutnost stále více a více využívat znečištěnou povrchovou vodu jako vodu pitnou. To znamená, že se nákladné způsoby čištění vody staly nezbytností.
Čištění vody
V následujících experimentech se dozvíte něco o metodách čištění vody, které lze využít i v případě pitné vody.
Experiment 37
Dodatečné pomůcky: voda z louže
Jeden z kruhových filtračních papírů přeložte způsobem, se kterým jste se seznámili v kapitole 5. Umístěte ho do nálevky a vyústění nálevky vsuňte do otvoru prázdné zkumavky. Bahnitou vodu či vodu z louže nalijte na filtrační papír. Kapalina kapající do zkumavky je mnohem čistší než roztok v nálevce. Vícenásobným opakováním filtrace byste získali čirý filtrát.
Při výrobě pitné vody však filtrace neprobíhá pouze přes filtrační papír, ale skrz vrstvy štěrku a písku. Na jemné stupně čištění vody byly vyvinuty speciální metody. Nejdříve však přípravný experiment.
Experiment 38
Dodatečné pomůcky: inkoust
Do zkumavky naplněné vodou přidejte 1 kapku černého nebo modrého inkoustu. Takto nápadně zbarvenou vodu přefiltrujte.
Tekutina překapaná skrze filtr se bude sotva něčím lišit od původního roztoku. Roztok uschovejte pro následující experiment. Filtrační papír sice skutečně malé množství inkoustu zachytí, většina však proteče skrz. Pigmentové částice inkoustu jsou tak malé, že bez problémů dokážou proniknout otvory i v takto jemném sítu.



Jemné čištění pitné vody aktivním uhlím. (Foto: Lurgi)
Tip
Recyklace aktivního uhlí
Vodu nechte několikrát protéct filtrem, aby se aktivní uhlí přemylo. Filtr s aktivním uhlím rozložte na talíř a nechte ho na teplém místě vyschnout. Aktivní uhlí můžete použít na další experiment nebo jej vrátit do chemické lahvičky.
Technologie a životní prostředí
Uhlí s velkou povrchovou plochou - aktivní uhlí - vyniká zahříváním materiálu obsahujícího uhlík , např. dřeva, na teplotu 500 - 900 °C v hermeticky uzavřeném prostředí za přítomnosti dehydratačních činidel. Takovým způsobem získáte porézní hmotu s extrémně velkou vnitřní povrchovou plochou - až 1 500 m2 na gram (m2/g). Aktivní uhlí je tedy schopno absorbovat značné množství rozpuštěných látek, plynů a par. Látky jsou vázány výlučně na povrchu. Termín označující tento druh vazby je adsorpce (z lat. Adsorbenty = nasávání). Aktivní uhlí hraje důležitou roli při jemném čištění pitné vody. Jeho schopnost adsorbovat plyny a páry se také využívá v plynových maskách a digestořích.
Čistá voda přes černé uhlí
Experiment 39
Do zkumavky odměřte 2 cm aktivního uhlí a rozdrťte jej na co nejjemnější prášek. Nejlepší výsledek docílíte, pokud zrnitou, granulovitou látku - odborně granulát - rozdrtíte uvnitř hladkého, přeloženého listu papíru pomocí tvrdého předmětu, jakým je například kladivo. Získaný prášek přesypte do zkumavky, tu do poloviny naplňte inkoustovou vodou z předchozího pokusu, zkumavku uzavřete a protřepávejte po dobu 30 až 40 sekund. Uvnitř zkumavky vznikne tmavě šedý až černý roztok. Přefiltrujte ho! Vzniklý filtrát bude mnohem světlejší. Aktivní uhlí na sebe navázalo část pigmentových částic.
Experiment 40
Dodatečné pomůcky: inkoust
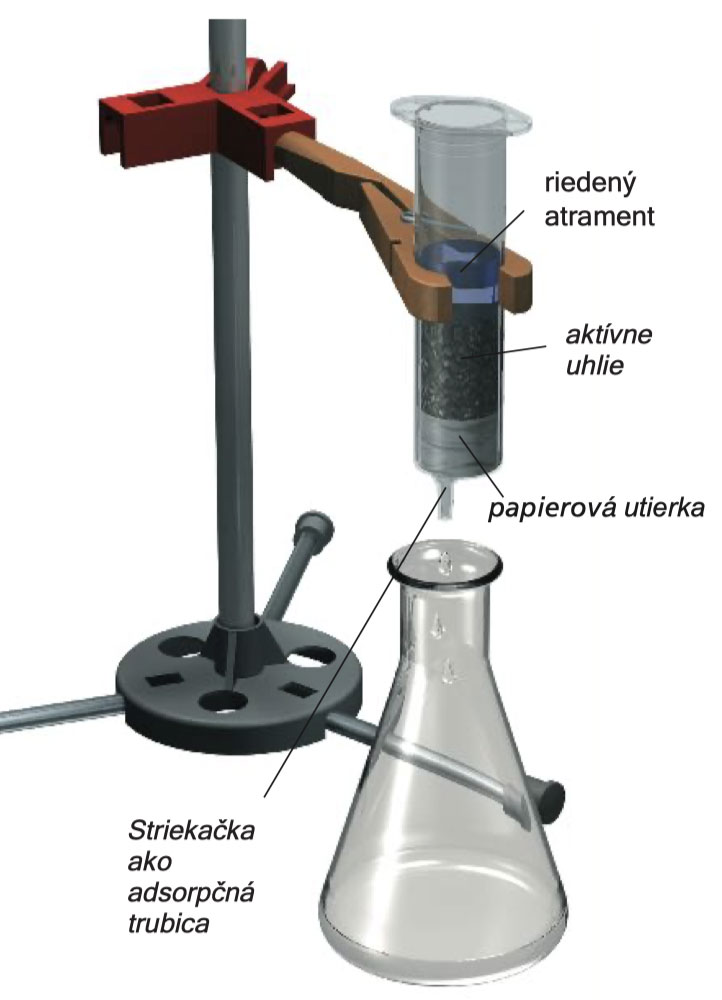
A teď vás čeká přeměna plastové stříkačky na adsorpční trubici. Ze stříkačky vytáhněte píst (budete muset použít trochu síly) a do prázdné trubice (těla) stříkačky vložte zátku zhotovenou z volně poskládané papírové utěrky. Sestavte experimentální aparaturu znázorněnou na obrázku. Do trubice postupně přidávejte malé množství vody, dokud z vyústění stříkačky nezačne kapat. Následně do těla stříkačky vložte usušené aktivní uhlí z experimentu 39. Stejným postupem jako v experimentu 38 si připravte inkoustovou vodu a pomalu ji trošku po trošce nalévejte na aktivní uhlí. Odkapávající roztok bude prakticky bezbarvý. V tomto experimentu jste kombinovali adsorpci a filtraci.
Znečišťující látky ohrožují podzemní vodu
Pokud se průmyslový odpad neskladuje v souladu s předpisy ve speciálních dedikovaných zařízeních pro nakládání s odpady, může dojít k přenosu ve vodě rozpustných znečišťujících látek dešťovou vodou do podzemních vod, dokonce i skrz několik metrů štěrku a písku. Následující experiment tento fakt demonstruje.
V případě síranu amonno-železitého věnujte pozornost informacím týkajícím se nebezpečných látek a směsí na str. 7-9.
Experiment 41
Dodatečný materiál: písek
Sestavte stejnou experimentální aparaturu jako v předchozím experimentu. Tentokrát však místo toho, abyste aktivní uhlí umístili nad zátku z papírové utěrky, nasypte písek do výšky sahající přibližně 2 cm pod horní okraj adsorpční trubice. Do písku vtlačte několik málo (!) krystalů síranu amonno-železitého a umístěte na něj další zátku zhotovenou z papírové utěrky. V Erlenmeyerově baňce odměřte 50 ml vody, přidejte několik kapek roztoku hexakyanoželeznatanu draselného a baňku umístěte pod vyústění adsorpční trubice. Vodu do zkumavky přidávejte v malých dávkách.
Kapalina, která nakonec trubicí proteče, zabarví obsah baňky modře, což dokazuje, že síran amonno-železitý pronikl skrz vrstvu písku do baňky (do pomyslné "podzemní vody"). Test přítomnosti železa prostřednictvím hexakyanoželeznatanu draselného znáte už z experimentu 15. A1
Experiment 42
Dodatečné pomůcky: zemina ze zahrady
Zopakujte předchozí experiment, tentokrát však do trubice vložte namísto písku trochu zeminy ze zahrady. Modrá barva by v tomto případě měla být slabší nebo by se měla objevit o něco později.
Půda obsahuje huminové materiály, které jsou do určité míry schopné "zachytit" kovové sloučeniny. Jinými slovy tyto materiály fungují stejně jako aktivní uhlí, byť jen v omezené míře. A1
Chemická fakta
Znečišťující látky putují přes vrstvy štěrku a písku do podzemní vody. Do určité míry je lze navázat prostřednictvím humusu.
Experiment 43
V odpařovací misce (experimentální aparatura str. 18) odpařte 10 až 20 ml vody z vodovodu. Myslíte, že by po vodě nemělo v misce zůstat absolutně nic? Pozorně vše pomocí lupy, pokud ji máte k dispozici, prozkoumejte blíže. Zjistíte, že se na spodku misky vytvořil tenký povlak.
V případě kyseliny chlorovodíkové věnujte pozornost informacím týkajícím se nebezpečných látek a směsí na str. 7-9.
Experiment 44

Toxické průmyslové odpady musí být řádně uskladněny na speciálních skládkách odpadů. (Foto: DPA)

In situ analýza vody využívající analytickou soupravu. (Foto: Macherey-Nagel)
Do misky přidejte několik kapek kyseliny chlorovodíkové. Zdá se, že vzniklý povlak reaguje na přítomnost kyseliny: uvidíte mnoho malých bublinek. A1
Množství povlaku, který vznikne během experimentu 43, závisí na tom, odkud použitá pitná voda pochází, a na oblasti, kde žijete. Tento povlak je tvořen takzvaným "vodním kamenem" či "sedlinou vodního kamene" (více v kapitole 17), který se při zahřívání odděluje z vody bohaté na vápník. V případě kontaktu usazeného vodního kamene s kyselinou dochází k úplnému nebo částečnému rozpuštění vodního kamene - v závislosti na specifických vlastnostech - a během reakce dochází k produkci plynu (pozorovatelného v podobě bublin), se kterým se při svých experimentech potkáte velmi často.
To znamená, že pitná voda není v žádném případě z chemického hlediska tak čistá jako destilovaná voda. A to je jen dobře. Požívání většího množství destilované vody by vedlo k nedostatku esenciálních minerálů v těle a způsobovalo by poškození buněk. Na druhou stranu parní kotle, vodovodní potrubí, autobaterie a parní žehličky by se v důsledku přítomnosti usazenin vápníku staly nepoužitelnými. Pro některé účely je tedy čistá voda nezbytná. Destilovaná voda by byla pro tento účel vhodná, je však příliš drahá, protože se na její výrobu spotřebuje příliš energie. Demineralizovaná voda, kterou na některé experimenty potřebujete, je vyráběna pomocí iontoměničů, využívajících speciální umělé pryskyřice schopné vázat minerály. Tyto pryskyřice pracují podobně jako humus v experimentu 42.
Složky vody
Řek Empedokles, který žil ve 4. století před naším letopočtem, pokládal vodu za jeden ze čtyř základních prvků. Podívejte se na diagram na str. 21. V tabulce vedle něj však vodu nenajdete a to by vás nemělo překvapit. V kapitole 3 jste se dozvěděli, že voda je chemickou sloučeninou prvků vodíku a kyslíku.

Vápník v pitné vodě se zachycuje na sklenicích, které se vlivem jeho přítomnosti zakalují.

Antoine Lavoisier. (Foto: German Chemical Society)

Historické zařízení na elektrolýzu vody.
Z. Stöckhardt, Škola chemie (1863)
Technologie a životní prostředí
Koloběh vody
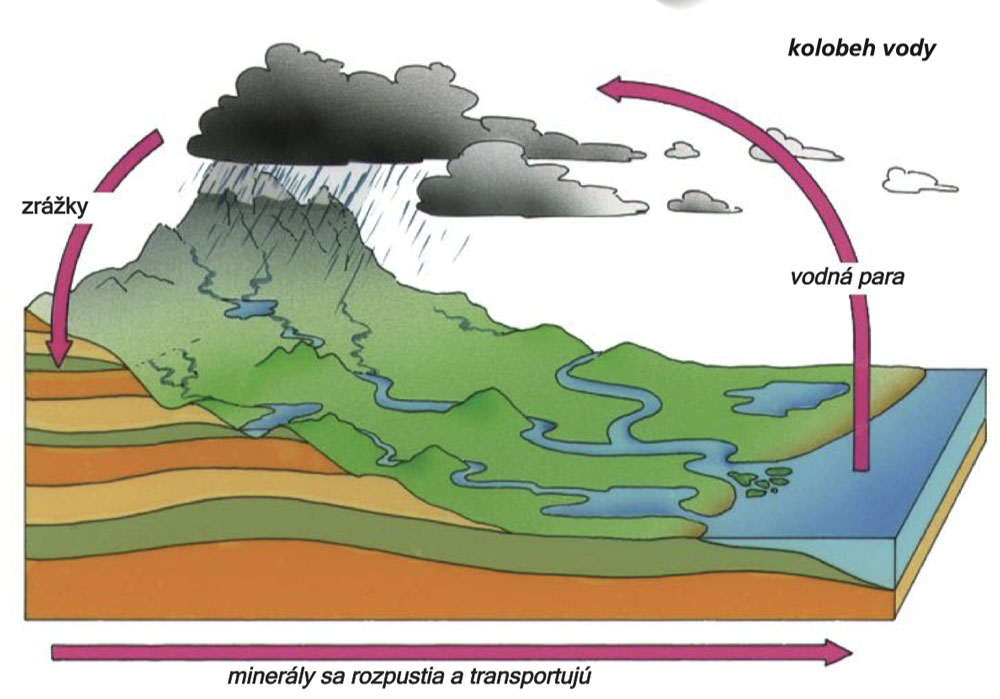
Jak se vůbec minerály jako např. vápník dostávají do pitné vody? Pocházejí z hornin a půdy, s nimiž voda přichází do styku na své dlouhé cestě do oceánu. Část vody v oceánu se vlivem zahřívání sluncem odpařuje. Vodní pára kondenzuje a vytváří tak oblaka, skládající se z malých kapek kapaliny. Pokud se obsah vody ve vzduchu zvýší nad určitou úroveň, vzduch ji už dál nezvládne zadržovat.
Do té doby zadržovaná voda následně padá jako déšť, částečně dopadající na pevninu. Déšť vniká do půdy, hromadí se, doplňuje zásoby podzemní vody a následně znovu spatří denní světlo ve formě vyvěrajících pramenů. Na cestě skrze skály a zeminu voda rozpouští mimo jiné vápenec, který s sebou dále odnáší jako rozpustnou složku až do našich kotlů a konvic na čaj. Většina materiálů rozpuštěných ve vodě však putuje řekami a potoky zpět do oceánu a hra - koloběh vody - může začít znovu.
Chemická fakta
Ve druhé polovině 18. století chemici neměli v koloběhu vody zcela jasno. Výsledky jejich zkoumání je však nasměrovaly k vytvoření celkového obrazu. Plynný, hořlavý prvek vodík objevil Henry Cavendish (1731-1810), který donutil kyseliny, reagovat s ušlechtilými kovy (tak, jak to učiníte vy v rámci experimentů 51 a 53). Cavendish mj také zjistil, že vodík při spalování produkuje vodu.
Antoine Lavoisier (1743-1793) na tuto problematiku nahlédl z jiného úhlu. Vodní páru nechal procházet přes rozžhavenou červenou hlavici tavicí pistole a získal tak vodík. Prvek kyslík, také obsažený ve vodě, zkombinoval se železem za vzniku oxidu železa. V průběhu toho, jak Lavoisier opět nechal vodík procházet přes rozžhavený plamen pistole, se vodík spojil s kyslíkem z oxidu železa za opětovného vzniku vody.
Vše bylo dostatečně jasné v době, kdy elektrolýza vody odstranila všechny zbývající pochybnosti. Zařízení jako to, které je zde znázorněno, využívalo elektrický proud k rozkladu vody na plynné složky. Můžete jasně vidět, že došlo k produkci dvojnásobně většího množství vodíku než kyslíku. Nicméně, celý proces fungoval velmi dobře pouze s platinovými elektrodami. Elektrody jsou typicky kovové komponenty, kterými je proud veden kapalinou nebo elektrolytem.
V rámci experimentů si budete muset vystačit s méně vzácnými kovy. I přesto však budete pozorovat stoupání plynů z obou elektrod.
Elektřina rozděluje vodu
V případě hydroxidu sodného věnujte pozornost informacím týkajícím se nebezpečných látek a směsí na str. 7-9.
Experiment 45
Dodatečné pomůcky: 2 lesklé železné hřebíky
Do malé odměrné kádinky nalijte 25 ml vody a přidejte 1 pipetu hydroxidu sodného.
Sestavte experimentální aparaturu, kterou vidíte na obrázku. Vaše zařízení na elektrolýzu vody využívá jako elektrolyt velmi zředěný hydroxid sodný a dva železné hřebíky jako elektrody.
Technické termíny: elektroda připojená k zápornému pólu baterie (-) se nazývá katoda, elektroda připojená ke kladnému pólu (+), se nazývá anoda.
Jakmile je elektrický obvod uzavřen, na obou elektrodách se rozběhne živá výroba plynu. Dávejte pozor, aby se hřebíky navzájem nedotkly - nastal by zkrat a baterie by přestala fungovat. Dokážete určit, zda na katodě dochází k výrobě většího množství plynu než na anodě? A2

To, co se vám chystáme říci, nebudete moci jednoduše rozeznat, a tak nám budete muset věřit: Na katodě dochází k uvolňování vodíku, přičemž na anodě se uvolňuje kyslík. Kromě toho plyny skutečně pocházejí z vody, ne z přidaného hydroxidu sodného, jenž jen pomáhá zajistit dobrou vodivost. Dochází k produkci dvojnásobně většího množství vodíku než kyslíku.
Chemická fakta
Během elektrolýzy vody se na katodě vytvářejí 2 díly vodíku a na anodě 1 díl kyslíku.
Jednoduchými prostředky, které máte k dispozici, je jen sotva možné zachytit vodík a kyslík uvolněné v průběhu předchozího experimentu. Vodík budete vyrábět pomocí Cavendishovy metody a o dvě kapitoly později se budete věnovat výrobě kyslíku z materiálů na něj bohatých. Nejprve však budete muset prostřednictvím několika experimentů získat trochu praxe v manipulaci s plyny. Jako příklad použijme vzduch, který na první pohled vypadá jako uniformní plyn. V následující kapitole se dozvíte, z čeho se vzduch opravdu skládá.
Zacházení s plyny
Při experimentování s plyny hraje důležitou roli tlak vzduchu. Ten nám umožňuje zachycovat plyny v nádobách naplněných vodou. Stojí však i za tlakem, kterým na nádoby, ve kterých se nachází vakuum, působí voda. Taková situace může nastat záměrně, avšak snadno k ní může dojít i vinou nepozornosti, která může vést k rozbití skla. Nejprve vyzkoušejme starý trik s nestárnoucí schopností ohromit.
Experiment 46
Dodatečné pomůcky: hladký karton nebo tvrdý papír
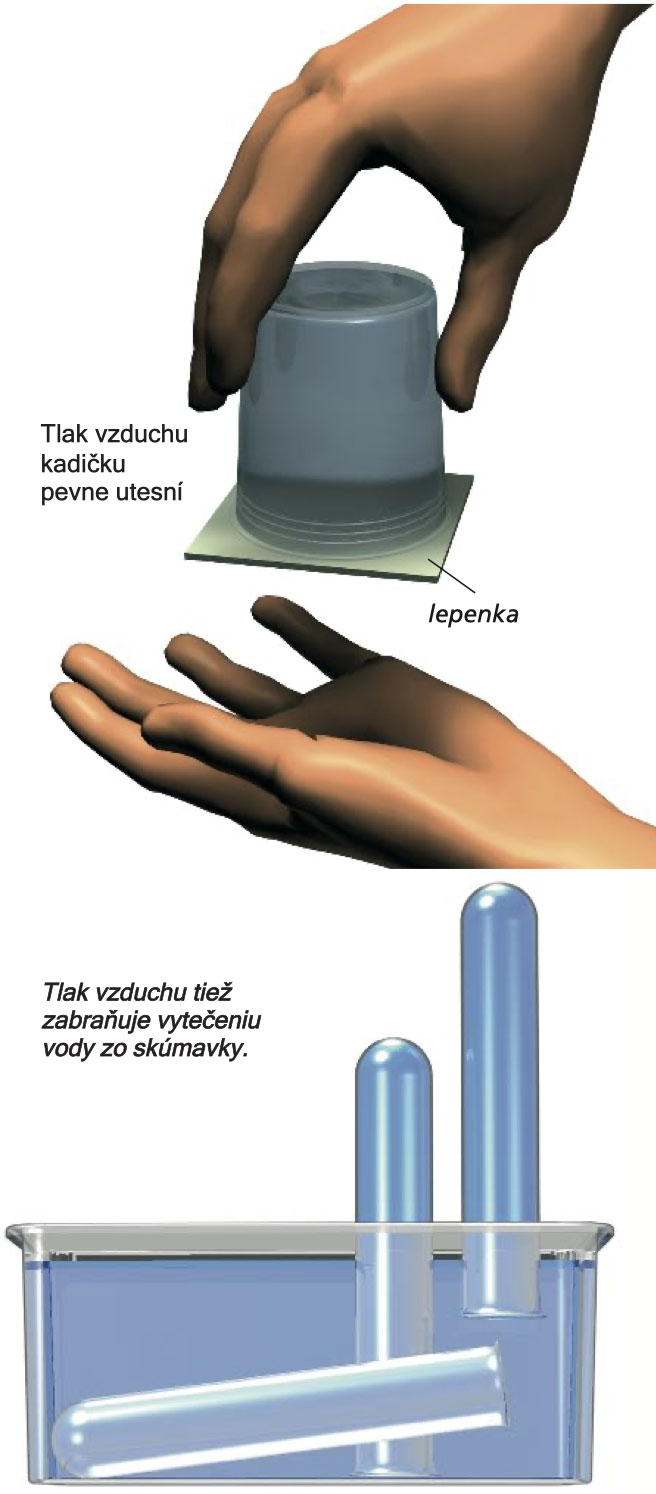
Malou nebo velkou odměrnou kádinku naplňte až po okraj (ideálně nad dřezem nebo velkou mísou) a na otvor kádinky položte kousek kartonu. Papír k otvoru kádinky pořádně přitlačte a otočte ji dnem vzhůru. Po otočení můžete karton pustit. Nespadne, dokud úplně nenasákne vodou.
Tlak vzduchu působí silou ze všech stran, dokonce i zdola - karton pevně přitlačí k nádobě naplněné vodou.
Experiment 47
Do mísy nalijte vodu alespoň do výšky 3 cm a na její dno umístěte zkumavku tak, aby se naplnila vodou. Zkumavku přemístěte do svislé polohy otevřeným koncem dolů tak, jak je znázorněno na obrázku. Voda nevyteče ze zkumavky. Tlak vzduchu v tomto případě funguje prostřednictvím jisté,, objížďky" skrz vodu nacházející se v nádrži.
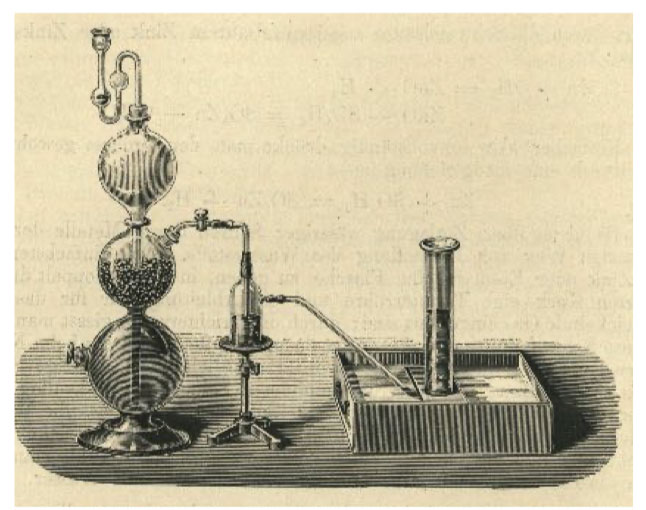
P. J. Kippův (1808-1864) klasický přístroj na nepřetržitou výrobu vodíku a dalších plynů. Za účelem výroby vodíku byla střední koule naplněna zinkem, zatímco horní a spodní obsahovaly kyselinu. Při otevřeném kohoutku dochází k reakci kyseliny se zinkem. Pokud je kohoutek zavřený, plyn kyselinu ze zinku vytěsní a produkce plynu se zastaví. Z. F. Krafft, Anorganická chemie (1891)
Chemická fakta
Tlak vzduchu dokáže vykompenzovat působení sloupce vody vysokého až 10 m.
Experiment 48
Dodatečné pomůcky: brčko na pití
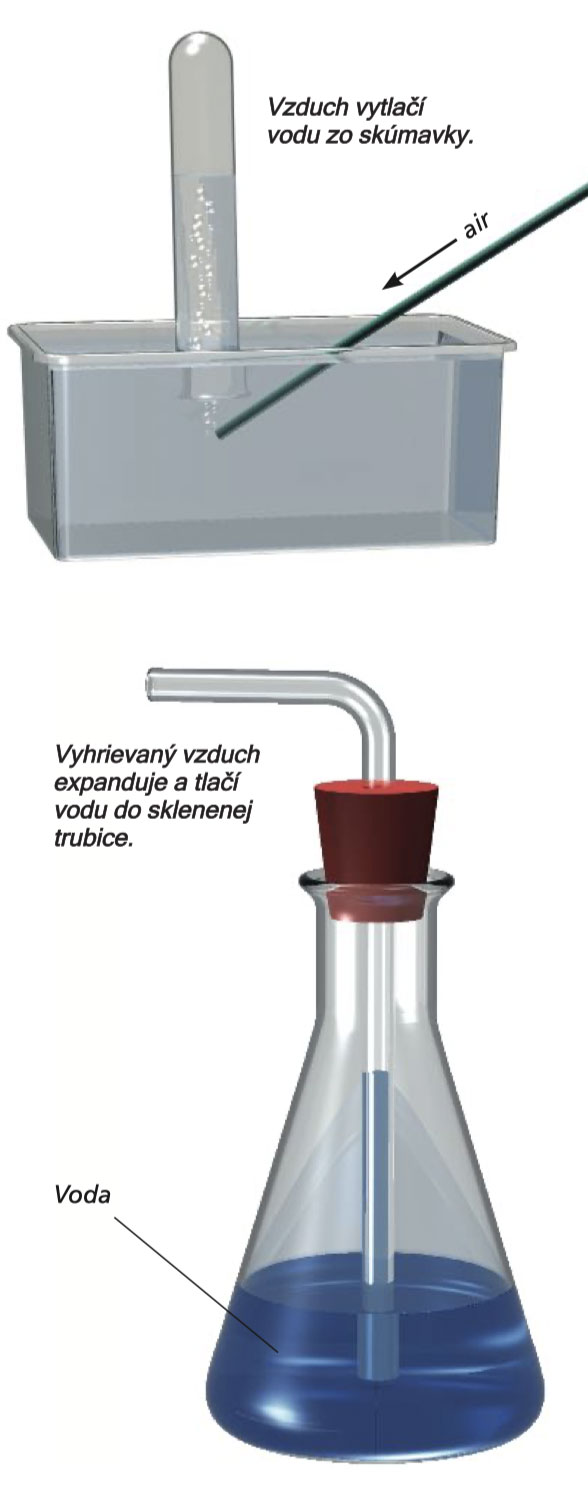
Jeden konec brčka podsuňte pod otvor vodou naplněné zkumavky a do druhého konce brčka opatrně foukněte. Vzduch, který do něj fouknete, vystoupá do zkumavky a nahradí tak vodu v části jejího objemu. Právě jste se naučili používat metodu, kterou při své práci chemici často využívají k jímání plynů ,,prostřednictvím vody". Název takového druhu aparatury je pneumatický žlab (z řeckého slova pneuma = vzduch, dech).
Teplo způsobuje rozpínání plynů...
... a chlad jejich objem opětovně zmenšuje. Mimochodem - totéž platí i pro ostatní pevné a kapalné látky, až na několik výjimek.
Při manipulaci se skleněnými zkumavkami buďte opatrní. Věnujte pozornost informacím uvedeným na str. 15. V případě zranění: viz První pomoc 7 (na vnitřní straně přední obálky).
Experiment 49
Z Erlenmeyerovy baňky se zátkou a skleněnou trubicí sestavte experimentální aparaturu, kterou vidíte znázorněnou na obrázku. Baňka obsahuje asi 30 ml vody a spodní konec skleněné trubičky dosahuje téměř na dno baňky. Když baňku uzavřete zátkou, voda vystoupí o několik centimetrů nahoru. Pokud (ne příliš studenou) rukou pevně uchopíte horní část baňky, vzduch v baňce se začne rozpínat a vytlačí vodu ještě výše do trubice, a je-li vaše ruka dostatečně teplá, voda může dokonce vystoupit až nad úroveň zátky.
Experiment 50
Erlenmeyerovu baňku podržte pod studenou tekoucí vodou. Nemělo by vám dělat problém vysvětlit, proč vodní sloupec klesá.
Proto byste měli být při ohřevu Erlenmeyerovy baňky nebo testovací zkumavky opatrní v případě, že z ní do pneumatického žlabu vede plynová trubice (skleněná trubice nebo hadička). Nejprve z vaničky vytáhněte plynovou trubici a až potom uhaste plamen! V opačném případě by se studená voda mohla dostat do chladicí (ale poměrně horké) skleněné nádoby. Dokonce i speciální sklo, ze kterého jsou vyrobeny vaše pomůcky, by to nevydrželo a rozbilo by se.
Vodík z kovu a kyseliny
V laboratoři není obvyklým způsobem výroby vodíku elektrolýza vody, ale vystavení neušlechtilých kovů kyselinám, stejně jako to udělal Cavendish. Již v roce 1839 si chemik Justus von Liebig (1803-1873) uvědomil, že všechny kyseliny jsou sloučeniny vodíku a že vodík může být zcela nebo částečně vytlačen kovy.
Vodík je společným znakem všech kyselin, zbytek kyseliny je však to, co je vzájemně od sebe odlišuje. Při reakci s kovy uniká vodík (označený šipkou směřující nahoru) a kov spolu se zbytkem kyseliny vytváří sůl (kuchyňská sůl není jediným druhem soli).
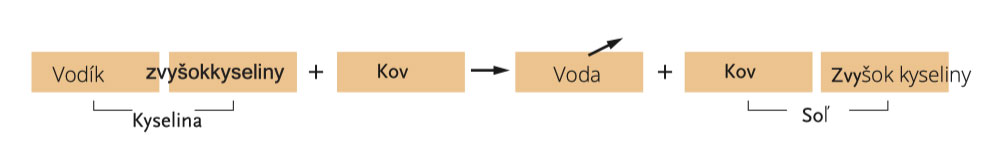
V případě kyseliny chlorovodíkové věnujte pozornost informacím týkajícím se nebezpečných látek a směsí na str. 7-9. Při manipulaci se skleněnými zkumavkami buďte opatrní. Věnujte pozornost informacím uvedeným na str. 15. V případě zranění: viz První pomoc 7 (na vnitřní straně přední obálky).
Experiment 51
Sestavte experimentální aparaturu znázorněnou na obrázku.
Do zkumavky, která bude sloužit jako nádoba na výrobu plynu, vložte 2 x 2 cm velký kousek zinkového plíšku (ohněte ho), úzký pásek měděného plíšku a do výšky 5 ml do zkumavky nalijte kyselinu chlorovodíkovou. Obsah zkumavky zahřívejte, dokud se výroba plynu pořádně nerozběhne. Jakmile bude výroba v plném proudu, hořák pod zkumavku podsouvejte už jen střídavě na krátkou dobu. Nedovolte, aby obsah zkumavky dosáhl bodu varu. Nechte uniknout prvních 10 až 15 plynových bublin a následně plyn zachyťte do dvou zkumavek, které naplníte postupně, jednu po druhé tak, jak je popsáno v experimentu 48. Jakmile se zkumavka naplní, podržte ji v ruce a uzavřete ji zátkou (použijte druhou zátku - s otvorem a malou skleněnou kuličkou).
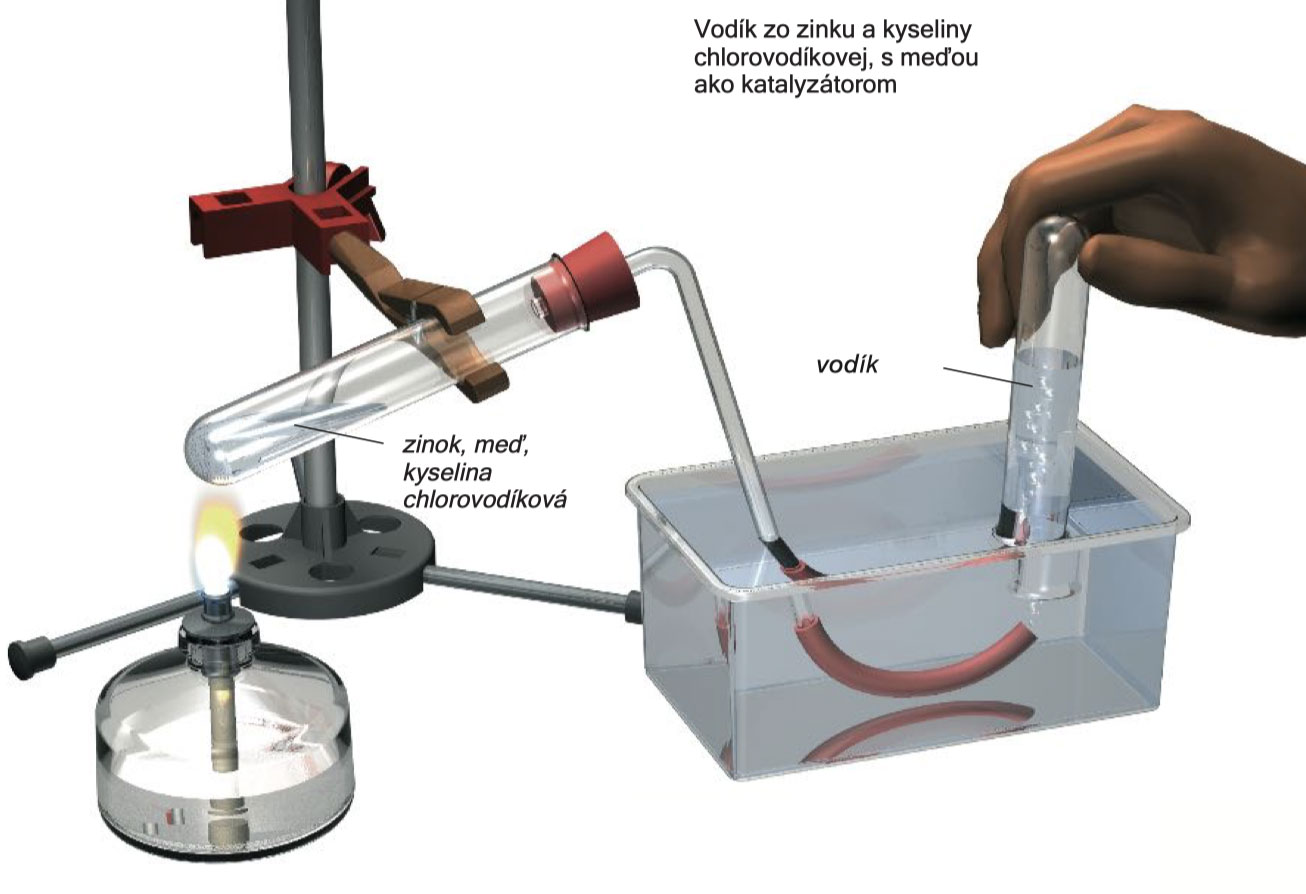
Experiment 52
Dodatečný materiál: kolíček na prádlo, pinzety
Zapalte lihový hořák. První naplněnou zkumavku uchopte pomocí kolíčku na prádlo nebo kroužku z tvrdého papíru a vyjměte ji z nádoby tak, aby byl její otevřený konec neustále nasměrován dolů. Odstraňte zátku a otvor zkumavky přidržte nad plamenem. Exploze je známkou toho, že se ve zkumavce stále nachází vzduch z nádoby na produkci plynu. Stejným způsobem pokračujte se zkumavkou, kterou jste naplnili jako druhou v pořadí. Doprovodný malý výbuch vodíku bude o něco tišší. Může se stát, že se stěny zkumavky orosí: to zkondenzovala voda, která vznikla během spalování vodíku.
Pozorně si prohlédněte zkumavku, v níž jste vyrobili vodík. Zinek v ní už z větší části nebo vůbec nenajdete. Pomocí pinzety vyjměte měděný pásek. Nebudou na něm znát žádné změny. Měď pomohla reakci urychlit procesem, o kterém se dozvíte více v rámci experimentu 167. Obsah zkumavky si odložte, budete ho potřebovat na experiment 54.
I ocet obsahuje vodík
Ocet budete potřebovat při mnoha různých experimentech.
Jelikož silně barevné nebo tmavé druhy octa mohou narušovat pozorovatelnost chemických reakcí, je nejlepší použít světlý nebo čirý ocet. Doporučuje se destilovaný bílý ocet s 5% kyselostí.
Hliník
Hliník (lat. Aluminium) je chemický prvek, který má v periodické tabulce prvků značku Al a atomové číslo 13. Patří mezi kovy s nízkou hustotou. Hliník je třetí nejrozšířenější prvek v zemské kůře (8,13 %). Větší zastoupení má už jen kyslík se 46,60 % a křemík s 22,72 %. S ostatními prvky vytváří několik sloučenin, které se významnou měrou podílejí na stavbě zemské kůry.
Více o hliníku na wiki.

Odpařování solných roztoků.
V případě hořčíku věnujte pozornost informacím týkajícím se nebezpečných látek a směsí na str. 7-9.
Experiment 53
Zopakujte experiment 51, tentokrát však namísto zinku použijte 5 cm dlouhý kousek hořčíkového pásku, který je obsažen v experimentální sadě, a jako kyselinu použijte ocet (destilovaný bílý ocet s 5% kyselostí). Jako výsledek opět získáte hořlavý plynný vodík. Obsah nádoby na výrobu plynu si uschovejte na experiment 55.
Kyselina chlorovodíková má chemický vzorec HCl, zatímco pro kyselinu octovou má vzorec tvar CH3COOH. Tučně zvýrazněné atomy H jsou společným znakem kyselin. Jak již věděl i Liebig, mohou být při experimentech nahrazeny kovy, tedy ve vašem případě zinkem a hořčíkem. Vodík uniká (zachytili jste ho) a kovy spolu se zbytky kyselin vytvářejí soli. V následujících pokusech budete z roztoků zmíněné soli zpětně získávat.
Odpařování roztoků
Nevdechujte výpary kyseliny chlorovodíkové ani kyseliny octové, k jejichž vzniku bude v průběhu následujících pokusů docházet! Experimenty provádějte venku nebo v blízkosti otevřeného okna!
V případě hydroxidu sodného věnujte pozornost informacím týkajícím se nebezpečných látek a směsí na str. 7-9.
Experiment 54
Vezměte zkumavku, kterou jste odložili po experimentu 52, v šikmé poloze ji upevněte do stojanu a její obsah spolu s varnou tyčinkou zahřívejte, dokud se polovina roztoku neodpaří. Zbytek nalijte do odpařovací misky a misku zahřejte na stojanu hořáku za pomoci drátěné mřížky. Na konci získáte bílou vrstvu, která bude nadále mírně růst a bobtnat, dokud se neodpaří i poslední zbytek vody. A3
Kromě unikajícího vodíku (↑) ze zinku a kyseliny chlorovodíkové vznikl i chlorid zinečnatý, ZnCl2.
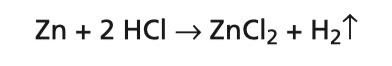
Experiment 55
Postupujte stejně jako v předchozím pokusu s roztokem, který jste si odložili na konci experimentu 53. Opět vznikne bílá krystalická vrstva. Dokažte, že se výsledná sůl velmi snadno rozpouští ve vodě. A1
Kromě vodíku jste z hořčíku a kyseliny octové vyrobili octan hořečnatý. Octan je název označující sůl kyseliny octové, o níž se dozvíte více v kapitole 20.
Vodík z hliníku a hydroxidu sodného
Experiment 56
Použijte stejnou experimentální aparaturu jako v experimentu 51 a do zkumavky vložte volně poskládanou kuličku z hliníkové fólie a nalijte do ní 5 ml hydroxidu sodného. I v tomto případě se reakce spustí po mírném zahřátí a následně bude bouřlivě pokračovat v důsledku přebytku energie uvolňované v průběhu reakce. Zachyťte vodík způsobem popsaným výše a proveďte "test vznětlivosti". A2
V kombinaci s hydroxidem sodným hliník produkuje vodík a hlinitan sodný, sloučeninu, jež obsahuje ionty sodíku a hliníku a má, ve své bezvodé formě, chemický vzorec NaAlO2. Hlinitan sodný má mimo jiné široké průmyslové využití, například při výrobě mýdel, papíru a barev, při úpravě sladké vody, jako změkčovač vody či jako stavební tmel při stavbě přehrad, tunelů či v konstrukcích mostů.
