Nastal čas naučiť sa niečo o ďalšej soli: chloride amónnom. Ľudia ho taktiež zvyknú nazývať amoniak ( ,, Amunova soľ‘‘) Chlorid amónny, rovnako ako jedlá sóda a sóda, je zásobárňou plynu. Hoci ste v predchádzajúcich prípadoch na separovanie oxidu uhličitého používali kyselinu, na oddelenie plynu – čpavku či amoniaku - z chloridu amónneho budete musieť použiť zásaditú látku. Začnime však so soľou.
Soľ, ktorá odvádza teplo
Venujte pozornosť poznámke vzťahujúcej sa k chloridu vápenatému v sekcii ,,Nebezpečné látky a zmesi‘‘ začínajúcej na strane č.7. Nasledujúce experimenty skúšajte na otvorenom priestranstve alebo v blízkosti otvoreného okna! Vznikajúce pary nevdychujte!
Experiment č.147
Do suchej, mierne naklonenej skúmavky nasypte 1 lyžicu chloridu amónneho tak, ako vidíte ilustrované na obrázku. Chlorid amónny v nej zahrejte. Pomocou uzavierateľného pohára zachyťte časť bielej hmly a pary unikajúcej zo skúmavky. Ak budete v zahrievaní pokračovať dostatočne dlho, chlorid amónny zo zahrievanej časti skúmavky zmizne úplne. Na druhej strane, v chladnejšej časti skúmavky v blízkosti otvoru a taktiež, menej badateľne, v pohári sa vytvorí biely povlak. Mimochodom, chlorid amónny sa vplyvom tepla neroztopil.

Poznámky za čiarou
Vezmite ťaví trus...
...a kuchynskú soľ, poriadne premiešajte a zohrejte. Tak nejak mohol znieť recept na výrobu amoniaku pochádzajúci zo starovekého Egypta. Pomenovanie amónna soľ pochádza z výrazu ,, Amunova soľ‘‘, z oázy nachádzajúcej sa v blízkosti Líbyjskej púšte (neďaleko dnešnej oázy Siwa). Táto oáza zvykla byť Amunovou svätyňou, ktorý bol uctievaný ako božstvo a neskôr stotožnený s bohom Slnka Re, z čoho vychádza pomenovanie Amun Re. Vďaka jeho vysokému postaveniu ho Gréci volali taktiež Zeus Amun a Rimania Jupiter Amun.
Z akého dôvodu však ťaví trus? Zvieracie exkrementy obsahujú zlúčeniny dusíka, ktoré zohrievané v kombinácii so soľou vytvárajú chlorid amónny obsahujúci uhlík a chlór.
Experiment č.148
Prostredníctvom obojstrannej odmernej lyžičky zoškrabte čo najviac vzniknutého bieleho povlaku a zohrejte ho v suchej skúmavke. Povlak, ktorý sa vytvoril, je zjavne chlorid amónny. A1
Otázka č. 30 - Poznáte tri rôzne skupenstvá vody?
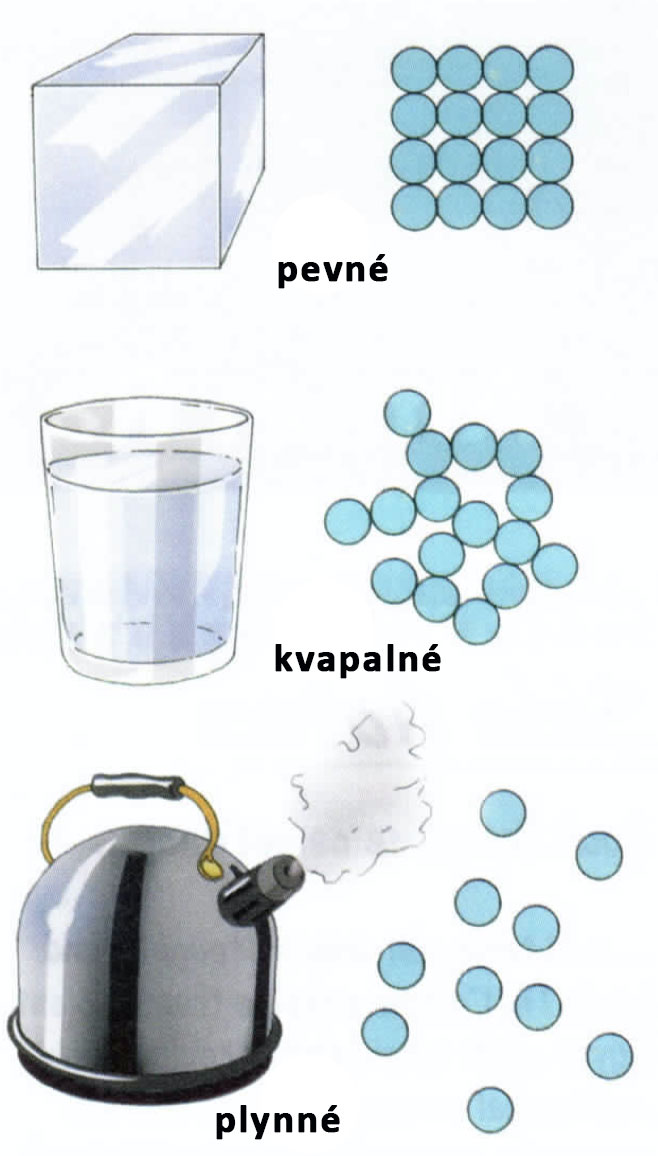
Látkové skupenstvá, používajúc vodu ako príklad.
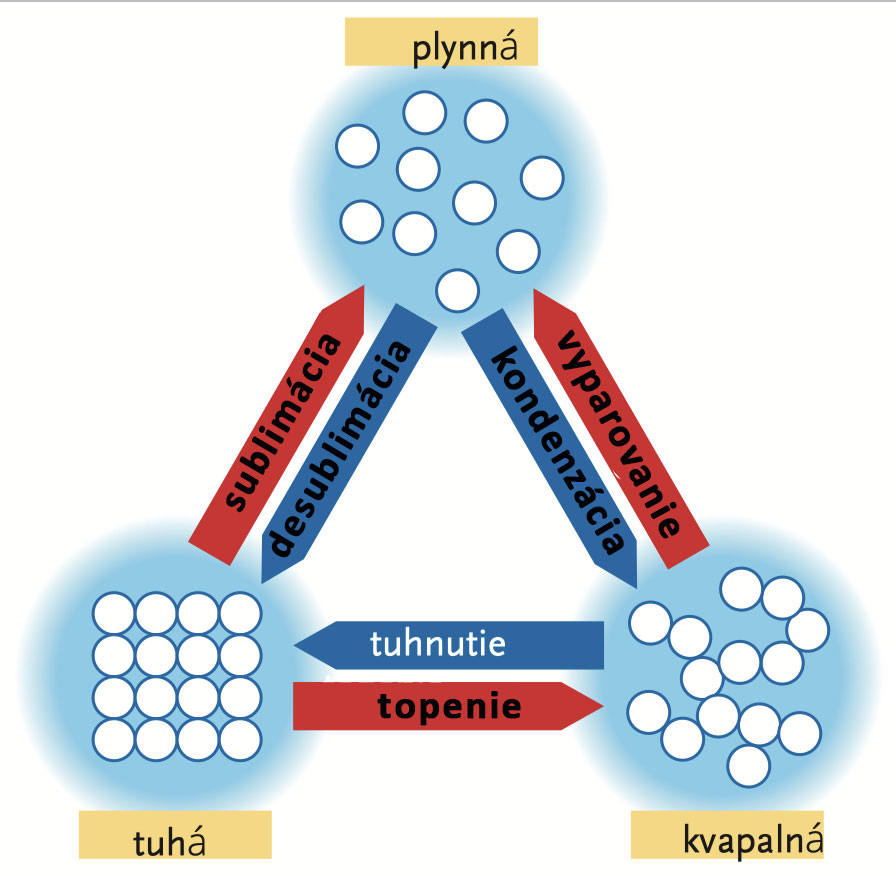
• Prechody a premeny medzi jednotlivými látkovými skupenstvami
Základné znalosti
O skupenstvách látok a prchavých pevných látkach
Fakt, že sa materiály skladajú z najmenších stavebných častíc, poskytuje jednoduché vysvetlenie existencie látkových skupenstiev. V pevnom skupenstve sú v látkach častice usporiadané, ako už viete, v kryštálových mriežkach. Majú len málo kinetickej energie a takmer sa nepohnú z miesta. Keď však látke v pevnom skupenstve dodáte teplo, ich energia sa zvýši. Látka z pevného skupenstva prejde na kvapalné. Pri určitej teplote dosiahnete bod topenia materiálu a kryštálová mriežka sa rozpadne. Látka sa stáva kvapalinou. Častice zostávajú pri sebe sú však pohyblivejšie. Pri dosiahnutí bodu varu materiálu je kinetická energia častíc dostatočne vysoká na to, aby z kvapaliny unikli do ovzdušia. V tomto momente látka prechádza do plynného stavu. Určité obzvlášť energetické častice sú schopné kvapalinu opustiť aj pred dosiahnutím bodu varu: kvapalina sa odparuje.
Existujú materiály, ktoré sa zohrievaním z pevného skupenstva premieňajú priamo na plyn bez toho, aby sa najskôr roztopili. Táto premena je známa ako sublimácia. Obrátený proces sa zase nazýva desublimácia a zohriata plynná látka sa pri ňom premieňa priamo späť na pevné skupenstvo. Práve k tomuto javu dochádza na chladnejšom konci skúmavky a v pohári v priebehu Experimentu 147. V Experimente 148 ste mali možnosť demonštrovať, že bol vzniknutý povlak tvorený chloridom amónnym.
V rámci separačných a čistiacich metód, medzi ktoré patrí metóda spomenutá v nasledujúcom experimente, referuje pojem sublimácia nielen k jednotlivému kroku, ale k celému procesu premeny : pevná látka – plynná látka – pevná látka. Produkt, ktorý je takýmto spôsobom očistený, nazývame sublimátom.
Venujte pozornosť poznámke vzťahujúcej sa k chloridu amónnemu v sekcii ,,Nebezpečné látky a zmesi‘‘ začínajúcej na strane č.7.
Experiment č.149
Do skúmavky nasypte odmeranú 1 lyžicu chloridu amónneho a 1 lyžicu kuchynskej soli. Postupujte podľa pokynov uvedených pri predchádzajúcom experimente. Zohrievaním bieleho povlaku v suchej skúmavke ukážte, že sa v ňom nenachádza kuchynská soľ- to znamená, že pozostáva čisto z chloridu amónneho. A1
Vzorec popisujúci chlorid amónny má tvar NH4Cl: spolu s jedným atómom dusíka (N), máme aj 4 atómy vodíka (H) a 1 atóm chlóru (Cl). V porovnaní s pevnými látkami, ktoré do plynného stavu prechádzajú nerozložené, sa chlorid amónny pri zahrievaní rozkladá na dva plyny: amoniak a chlorovodík.
NH4Cl ---> NH3 + HCl
Schladením a oba plyny opäť kombinujú a spájajú za vzniku chloridu amónneho.
Užitočnosť chloridu amónneho ako spájkovačky závisí taktiež na tepelnom rozklade. Na to, aby spájkovacie zlúčeniny držali, nesmú kovové spájané povrchy obsahovať nijaké nečistoty.
Experiment č.150
Dodatočné materiály a pomôcky: hliníková fólia alebo kovový vrchnák
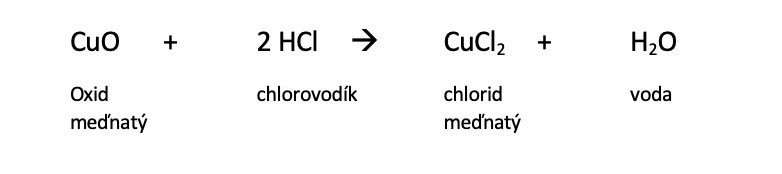
Na kúsok hliníkovej fólie alebo kovový vrchnák položte 1 lyžicu chloridu amónneho. Medený drôt uchopte pomocou držiaka na skúmavky a jeho druhý koniec držte nad plameňom liehového horáka. Drôt v plameni sčernie a vytvorí sa na ňom tenká vrstvička oxidu meďnatého (CuO). Ešte horúci drôt ponorte do chloridu amónneho a následne ho opäť vráťte nad plameň horáka. Vrstvička oxidu zmizne, opäť sa objaví lesklá žiarivá meď a plameň horáka sa na malú chvíľu zafarbí na zeleno. Chlorid amónny : A1
Chlorovodík, vznikajúci pri tepelnom rozklade chloridu amónneho, sa naviaže na oxid meďnatý za vzniku chloridu meďnatého (CuCl2), ktorý pri odparovaní zafarbuje plameň horáku na zeleno:
Plyn s ostrým zápachom
Experiment vykonávajte na vonkajšom priestranstve alebo pri otvorenom okne. Po dokončení pokusu miestnosť dobre vyvetrajte. Dodržujte pokyny týkajúce sa odporúčaných množstiev jednotlivých látok potrebných k Experimentu.
Amoniak je pri vdýchnutí toxický a môže spôsobovať vážne popáleniny kože a poškodenie zraku. – Plyn nevdychujte. - V PRÍPADE VDÝCHNUTIA: Postihnutého presuňte von z miestnosti na čerstvý vzduch a udržujte ho v pokoji a polohe pohodlnej na dýchanie. -V PRÍPADE KONTAKTU S OČAMI: Oči opatrne oplachujte vodou po dobu niekoľkých minút. V prípade, že má postihnutá osoba nasadené kontaktné šošovky ich, ak je to možné, vyberte. Pokračujte vo vyplachovaní. -Okamžite kontaktujte Národné kontaktné miesto pre chemickú bezpečnosť, prípadne zavolajte doktora
Na odseparovanie plynného amoniaku od chlorovodíku nestačí tieto plyny jednoducho zohriať. Látka sa totiž po ochladení opätovne sformuje do pôvodnej podoby. Aby sa vám podarilo amoniak oddeliť, musíte na vhodnú látku naviazať chlorovodík vznikajúci pri dekompozícii chloridu amónneho – napríklad na hydroxid vápenatý, Ca(OH)2 :
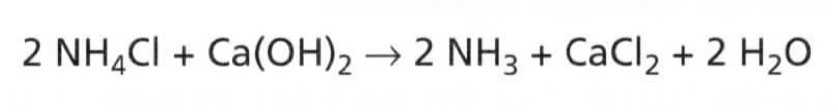
V prípade, že by vám vyššie uvedený zápis pripadal príliš komplikovaný, prepíšeme rovnicu reakcie nasledovne ( NH3HCl pravdaže nie je nič iné ako NH4Cl):
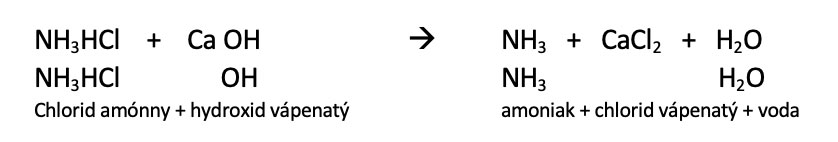
Venujte pozornosť poznámke vzťahujúcej sa k hydroxidu vápenatému v sekcii ,,Nebezpečné látky a zmesi‘‘ začínajúcej na strane č.7.
Experiment č.151
V skúmavke zmiešajte jednu lyžicu chloridu amónneho a jednu lyžicu hydroxidu vápenatého. Skúmavku uzavrite zátkou (Palcom zátku pridržiavajte na mieste!) a jemne ňou potraste. Skúmavku otvorte a opatrne k sebe rukou privejte malý závan unikajúcich výparov. A2
Do nosa vás udrie vôňa charakteristická pre niektoré čistiace prostriedky. Prúžok vlhkého červeného lakmusového papieriku podržte na okraji otvoru skúmavky tak, aby sa nedotýkal stien. Prečo sa jeho farba zmenila na modrú? Reaguje amoniak zásadito?

Meď sa pri zahrievaní pokryje vrstvičkou oxidu meďnatého; pri zahrievaní v prítomnosti chloridu amónneho reaguje oxid meďnatý s chlorovodíkom za vzniku chloridu meďnatého, ktorý zafarbuje plameň nazeleno.

• Molekula amoniaku, NH3

Moderná vysokotlaková pec na výrobu amoniaku ( fotografia: Chemical Industry Fund)

Síran amónny – často používané hnojivo s obsahom dusíka (fotografia: BASF)
Technológie a životné prostredie - Dusík zo vzduchu
V modernej ekonomike zohráva amoniak dôležitú úlohu. Ľudstvo by sa nedostalo ďaleko, ak by sa s jeho výrobou spoliehalo na ťaví či iní zvierací trus. Vo veľkých množstvách je amoniak vyrábaný pomocou vysokotlakovej syntetickej metódy, ktorej vynálezcom sú Carl Bosch (1874 – 1940) a Fritz Haber (1868 – 1934). Termín ,,syntéza‘‘ označuje proces, v ktorom dochádza ku kombinácii a spojeniu počiatočných materiálov vstupujúcich do reakcia za vzniku novej látky.
Látkami, ktoré do reakcie v prípade syntézy amoniaku vstupujú, sú dva prvky : dusík a vodík. Dusík získavame zo vzduchu, v ktorom je zastúpený približne 80%.
Vodík je obvykle získavaný konverziou metánového plynu (CH4) obsiahnutého v zemnom plyne prostredníctvom vodnej pary.
Reakcia medzi dusíkom a vodíkom prebieha v špeciálnych reaktoroch pri tlaku 200 až 300 barov (inými slovami – pri tlaku 200 – 300 väčšom ako atmosférický tlak) za prítomnosti katalyzátoru:
N2 + 3 H2 --> 2 NH3
Takýmto spôsobom vyrobený amoniak je následne oddelený z reakčnej zmesi jej skvapalnením pri vysokom tlaku . V chemickom priemysle sa amoniak, okrem iného, používa na výrobu kyseliny dusičnej, sódy, sodného popola (vyrábaného Solvayovým procesom) a soľných hnojív (síranu amónneho).
Nie plyn, ale vodný roztok. Amoniak s vodou reaguje nasledovne:
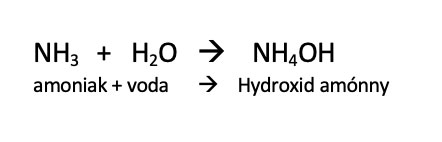
Hydroxid amónny je tvorený amónnymi iónmi NH4+ a hydroxidovými iónmi OH-, ktoré sú zodpovedné za zásaditú reakciu roztoku.
Vyrobme si amónny lieh
Amónny lieh predstavuje prchavú komponentu, ktorú možno uvoľniť z chloridu amónneho tak ,ako sa vám to podarilo v rámci Experimentu 151 s amónnym plynom. V dnešnej dobe, v rámci toho, do akej miery sa pojem ,,amónny lieh‘‘ používa, ním ľudia adresujú vodný roztok amoniaku, taktiež známy ako amónna voda. V nasledujúcich experimentoch budete vyrábať roztoky obsahujúce amoniak.
Venujte pozornosť poznámke vzťahujúcej sa k chloridu amónnemu, hydroxidu vápenatému a uhličitanu sodnému v sekcii ,,Nebezpečné látky a zmesi‘‘ začínajúcej na strane č.7.
Experiment č.152
Do skúmavky obsahujúcej 2 lyžice chloridu amónneho a 2 lyžice hydroxidu vápenatého dolejte do výšky 4-5 cm vodu, skúmavku uzavrite zátkou (Palcom ju zvrchu pridržiavajte!) a jej obsah pretrepte. Nepriehľadnú, mierne kalnú kvapalinu prefiltrujte do ďalšej skúmavky. Použite dvojitú vrstvu filtračného papiera. Opatrne si privoňajte k hrdlu skúmavky (nenadychujte sa zhlboka). Typická vôňa amoniaku! Pri otvore skúmavky podržte prúžok navlhčeného červeného lakmusového papieriku tak, aby ste sa nedotýkal stien skúmavky. Jasné modré sfarbenie papieriku indikujte prítomnosť prchavého amoniaku. Usadeniny :A2, filtrát: uschovajte na Experiment 153, usadenina: A2.
Otázka č. 31 – Prečo by sa lakmusový pásik nemal dotknúť stien skúmavky?
Experiment č.153
Časť filtrátu získaného v Experimente 152 rozpustite v päťnásobnom objeme vody a do vzniknutého roztoku pridajte trochu roztoku uhličitanu sodného. V skúmavke vám vznikne biela usadenina. Otestujte, ako bude reagovať, keď k nej pridáte trochu octu. A2
Roztok z Experimentu 152 obsahuje amoniak, avšak nie je jeho čistým roztokom. Tak, ako reakčná rovnica na strane 79 indikuje, roztok obsahuje aj vedľajší produkt -chlorid uhličitý, ktorý v roztoku uhličitanu sodného vytvára zrazeninu uhličitanu vápenatého. Uhličitan vápenatý je rozpustný v kyseline octovej.
Experiment č.154
Zopakujte postup uvedený v popise Experimentu 152, namiesto hydroxidu vápenatého však použite uhličitan sodný. Tentokrát číry roztok získate okamžite a filtráciu nebudete potrebovať. Získaný roztok si uschovajte na ďalšie experimenty.
Modrý, neviditeľný atrament
Venujte pozornosť poznámke vzťahujúcej sa k síranu meďnatému v sekcii ,,Nebezpečné látky a zmesi‘‘ začínajúcej na strane č.7.
Experiment č.155
Dodatočné materiály a pomôcky: pero s oceľovým hrotom alebo jemný,tenký, umelecký štetec
1 lyžicu síranu meďnatého rozpustite v objeme vody siahajúcom do výšky 3 cm a výsledný bledomodrý roztok použite ako neviditeľný atrament na napísanie odkazu, ideálne na svetlomodrý papier. Na to, aby ste si napísanú správu mohli opäť prečítať vy alebo adresát tohto tajného odkazu, použite amoniakový roztok, ktorý ste si odložili po dokončení prechádzajúceho experimentu. Roztokom namočte kúsok filtračného papiera ( tak, že naň pomocou pipety kvapnete niekoľko kvapiek roztoku), priložte ho na papier, na ktorý ste napísali tajný odkaz, a pritlačte. Písmená sa sfarbia jasnou modrou farbou. A2, A3
Modrú farbu písmen má na svedomí zlúčenina medi a amoniaku, s ktorou sa opäť stretnete v Kapitole 13.
Prchavá soľ
Možno ste v starých filmoch z dávnejších dôb videli scény, v ktorých bolo dámy a slečny potrebné vzkriesiť po tom, ako boli vplyvom čara vonných solí uvrhnuté do hlbokého spánku. Takéto soli, ktoré zvykli byť často známe pod vtipne znejúcimi názvami ako ,,jelenia soľ‘‘, avšak nie sú, z chemického hľadiska, ničím iným než uhličitanom amónnym a/alebo bikarbonátom amónnym, ktoré sa v Európe dodnes používajú ako kypridlo na prípravu vianočných perníkov. ,,Jelenia soľ‘‘ môžete dodnes objaviť v niektorých špecializovaných obchodoch (pravdepodobne pod názvom Hirschhornsalz či salajka).
Venujte pozornosť poznámke vzťahujúcej sa k jelenej soli v sekcii ,,Nebezpečné látky a zmesi‘‘ začínajúcej na strane č.7.
Experiment č.156
Do skúmavky nasypte 2 lyžice jelenej soli a veľmi opatrne ho vyskúšajte ovoňať (trošku si privoňajte k obsahu skúmavky). Do nosa vám udrie vôňa amoniaku, ktorá môže byť o to slabšia, čím dlhšie bol produkt v nádobke uložený. Na porovnanie skúste ovoňať aj liekovku obsahujúcu chlorid amónny. V tomto prípade neucítite známy zápach amoniaku. To, že je amoniak v jelenej soli viazaný oveľa slabšie než v chloride amónnom je možné pozorovať aj porovnaním rozličných hodnôt pH vodných roztokov týchto dvoch látok.
Experiment č.157
Lorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempor incididunt ut labore et dolore magna aliqua. Ut enim ad minim veniam, quis nostrud exercitation ullamco laboris nisi ut aliquip ex ea commodo consequat. Duis aute irure dolor in reprehenderit in voluptate velit esse cillum dolore eu fugiat nulla pariatur.

Výroba amoniaku zo zvieracích kostí – od dôb starovekého Egypta sa sotva niečo zmenilo; zo Stockhardtu, Školy chémie (1863)

Poznámky za čiarou
Jelenia soľ
Možno ste už počuli o alchymistoch, predchodcoch dnešných chemikov. Aj keď sa im nedarilo premieňať základné kovy na zlato, učinili mnoho veľmi dôležitých objavov v oblasti chemických látok. Soľ, ktorú sa im podarilo vyrobiť zohrievaním zvieracích zvyškov –napríklad parohov, rohov, kopýt či pazúrov - obsahujúcich bielkoviny, bola veľmi vzácna, vážená a využívaná na medicínske účely. Obzvlášť pôsobivé bolo, že sa soľ už pri izbovej teplote stávala prchavou a uvoľňovala pri tom amoniak či iné plyny, ktoré ho obsahovali. Soľ pomenovali alkali volubile či prchavá zásada.
V dnešnej dobe je uhličitan vápenatý, ktorý je prchavou zložkou jelenej soli, vyrábaný zohrievaním zmesi síranu amónneho a uhličitanu vápenatého. Nepoužíva sa len ako kypridlo pri pečené, ale aj na mnohé iné účely ako napr. v náplni do hasiacich prístrojov.
Experiment č.158
Predchádzajúci experiment zopakujte, avšak ako indikátor použite lakmusový roztok ( do každej zo skúmaviek ho pridajte niekoľko kvapiek). Roztok chloridu amónneho sa zafarbí na červenkasto fialovo (mierne zásadito) , zatiaľ čo roztok jelenej soli sa sfarbí na modro (zásadito). A1
Venujte pozornosť poznámke vzťahujúcej sa k hydroxidu vápenatému a vápennej vode v sekcii ,,Nebezpečné látky a zmesi‘‘ začínajúcej na strane č.7.
Pri zasúvaní zahnutej sklenej trubice do zátky buďte opatrní! Prečítajte si bezpečnostné informácie uvedené na stránkach 13/14. V prípade, že došlo k zraneniu : Prvá pomoc 7 (vnútorná strana prednej obálky).
Experiment č.159
Do výšky 3 cm v skúmavke nalejte vápennú vodu a skúmavku umiestnite do stojana. Kratšie rameno zahnutej skúmavky zasuňte do gumenej zátky. Do druhej skúmavky pridajte 2 lyžice jelenej soli a do výšky 2 cm skúmavku naplňte octom. Vo chvíli, keď pena prestane stúpať skúmavku uzavrite zátkou a voľný koniec zahnutej trubice ponorte do vápennej vody. Nedovoľte však, aby sa pena či kvapalina prostredníctvom zahnutej trubice dostali do kontaktu s vápennou vodou. Vznik bielej zrazeniny indikuje prítomnosť oxidu uhličitého. A1
Jelenia soľ obsahuje oboje – amoniak aj oxid uhličitý. Nie je jednoduchou látkou, ale zlúčeninou viacerých materiálov – zmesou. Zväčša je z jednej časti tvorená uhličitanom amónnym, (NH4)2CO3, a z dvoch častí hydrogénuhličitanom amónnym, NH4HCO3.
Experiment č.160
Do suchej skúmavky pridajte 2 lyžice jelenej soli a zohrejte ju nad plameňom liehového horáka. Hrdlo skúmavky nad plameňom držte trochu naklonené. Okolo chladnejšieho otvoru skúmavky sa opäť vytvoria kondenzované kvapky vody, avšak soľný povlak, ako v prípade chloridu amónneho, sa nevytvorí. Soľ sa napokon odparí po tom, ako prejde kompletnou premenou a rozkladom na amoniak, oxid uhličitý a vodu. Inými slovami, vznikajú len plyny. Aj voda sa pri teplotách nad 100°C stáva plynom. Jelenia soľ tak perfektne splňuje požiadavky na kypridlo používané pri pečení koláčov – cestu zjemňuje a zľahčuje prostredníctvom produkcie plynov.
