Nastal čas naučit se něco o další soli: chloridu amonném. Lidé ho také nazývají amoniak (,,Amunova sůl''). Chlorid amonný stejně jako jedlá soda a soda je zásobárnou plynu. Přestože jste v předchozích případech k separování oxidu uhličitého používali kyselinu, k oddělení plynu - čpavku či amoniaku - z chloridu amonného budete muset použít zásaditou látku. Začněme však se solí.
Sůl, která odvádí teplo
Věnujte pozornost poznámce vztahující se k chloridu vápenatému v sekci ,,Nebezpečné látky a směsi'', začínající na straně č. 7. Následující experimenty provádějte na otevřeném prostranství nebo v blízkosti otevřeného okna! Vznikající páry nevdechujte!
Experiment č. 147
Do suché, mírně nakloněné zkumavky nasypte
1 lžíci chloridu amonného tak, jak vidíte na obrázku. Chlorid amonný v ní zahřejte. Pomocí uzavíratelné sklenice zachyťte část bílé mlhy a páry unikající ze zkumavky. Pokud budete v zahřívání pokračovat dostatečně dlouho, chlorid amonný ze zahřívané části zkumavky zmizí úplně. Na druhou stranu se v chladnější části zkumavky v blízkosti otvoru a také, méně znatelně, ve sklenici vytvoří bílý povlak. Mimochodem, chlorid amonný vlivem tepla neroztaje.

Poznámky pod čarou
Vezměte velbloudí trus...
... a kuchyňskou sůl, pořádně promíchejte a zahřejte. Tak nějak mohl znít recept na výrobu amoniaku pocházející ze starověkého Egypta. Pojmenování amonná sůl pochází z výrazu ,,Amunova sůl'', z oázy nacházející se v blízkosti Libyjské pouště (nedaleko dnešní oázy Siwa). Tato oáza byla Amunovou svatyní, Amun byl uctíván jako božstvo a později ztotožněn s bohem Slunce Re, z čehož vychází pojmenování Amun Re. Díky jeho vysokému postavení ho Řekové nazývali také Zeus Amun a Římané Jupiter Amun.
Z jakého důvodu však velbloudí trus? Zvířecí exkrementy obsahují sloučeniny dusíku, které zahřívané v kombinaci se solí vytvářejí chlorid amonný, obsahující uhlík a chlór.
Experiment č. 148
Prostřednictvím oboustranné odměrné lžičky seškrabejte co nejvíce vzniklého bílého povlaku a zahřejte jej v suché zkumavce. Povlak, který se vytvořil, je zjevně chlorid amonný. A1
Otázka č. 30: Znáte tři různá skupenství vody?
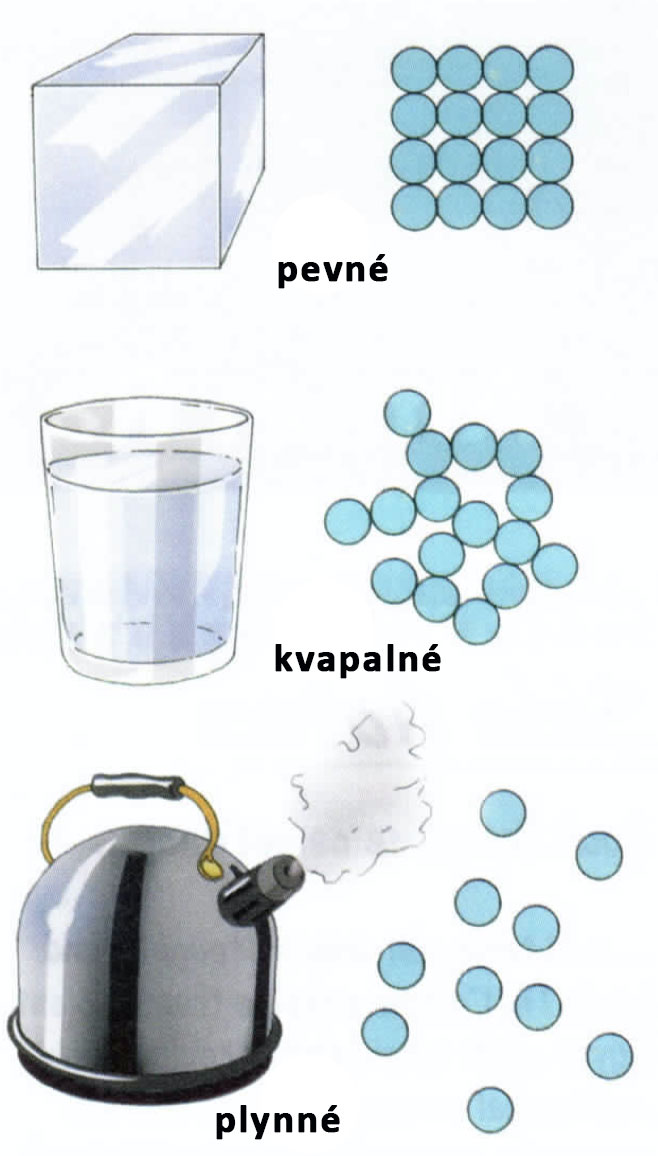
Látková skupenství, jako příklad jsme použili vodu.
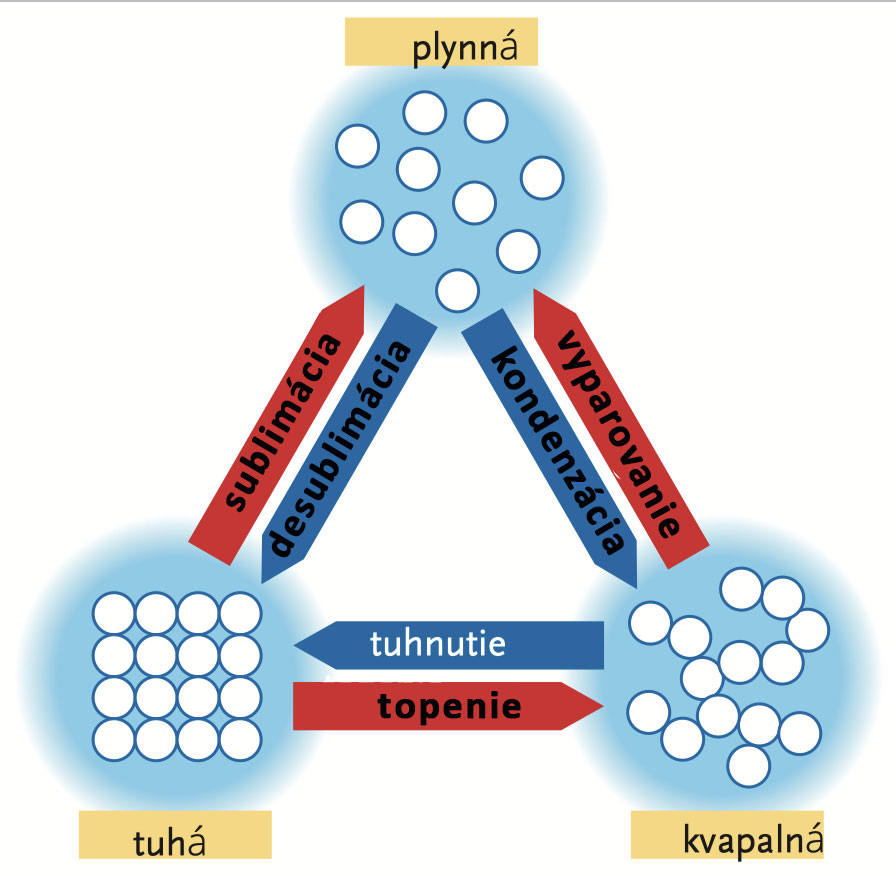
• Přechody a přeměny mezi jednotlivými látkovými skupenstvími.
Základní znalosti
O skupenstvích látek a těkavých pevných látkách
Fakt, že se materiály skládají z nejmenších stavebních částic, poskytuje jednoduché vysvětlení existence látkových skupenství. V pevném skupenství jsou v látkách částice uspořádány, jak už víte, v krystalových mřížkách. Mají jen málo kinetické energie a téměř se nepohnou z místa. Když však látce v pevném skupenství dodáte teplo, jejich energie se zvýší. Látka z pevného skupenství přejde do kapalného. Při určité teplotě dosáhnete bodu tání materiálu a krystalová mřížka se rozpadne. Látka se stává kapalinou. Částice zůstávají u sebe, jsou však pohyblivější. Při dosažení bodu varu materiálu je kinetická energie částic dostatečně vysoká na to, aby z kapaliny unikly do ovzduší. V tomto okamžiku látka přechází do plynného stavu. Určité, obzvláště energetické částice jsou schopné kapalinu opustit i před dosažením bodu varu: kapalina se odpařuje.
Existují materiály, které se zahříváním z pevného skupenství přeměňují přímo na plyn, aniž by nejprve roztály. Tato přeměna je známá jako sublimace. Obrácený proces se zase nazývá desublimace a ohřátá plynná látka se při ní přeměňuje přímo zpět na pevné skupenství. Právě k tomuto jevu dochází na chladnějším konci zkumavky a ve sklenici v průběhu experimentu 147. V experimentu 148 jste měli možnost demonstrovat, že byl vzniklý povlak tvořen chloridem amonným.
V rámci separačních a čisticích metod, mezi které patří metoda zmíněná v následujícím experimentu, zahrnuje pojem sublimace nejen jednotlivý krok, ale celý proces přeměny: pevná látka - plynná látka - pevná látka. Produkt, který je tímto způsobem očištěn, nazýváme sublimát.
Věnujte pozornost poznámce vztahující se ke chloridu amonnému v sekci ,,Nebezpečné látky a směsi'', začínající na straně č. 7.
Experiment č. 149
Do zkumavky nasypte odměřenou 1 lžíci chloridu amonného a 1 lžíci kuchyňské soli. Postupujte podle pokynů uvedených u předchozího experimentu. Zahříváním bílého povlaku v suché zkumavce demonstrujte, že se v něm nenachází kuchyňská sůl, to znamená, že sestává čistě z chloridu amonného. A1
Vzorec popisující chlorid amonný má tvar NH4Cl: spolu s jedním atomem dusíku (N), máme i 4 atomy vodíku (H) a 1 atom chlóru (Cl). Ve srovnání s pevnými látkami, které do plynného stavu procházejí nerozložené, se chlorid amonný při zahřívání rozkládá na dva plyny: amoniak a chlorovodík:
NH4Cl ---> NH3 + HCl
Zchlazením se oba plyny opět míchají a spojují za vzniku chloridu amonného.
Užitečnost chloridu amonného jako pájecího materiálu závisí také na tepelném rozkladu. K tomu, aby pájecí sloučeniny držely, nesmí spojované kovové povrchy obsahovat žádné nečistoty.
Experiment č. 150
Dodatečné materiály a pomůcky: hliníková fólie nebo kovové víko
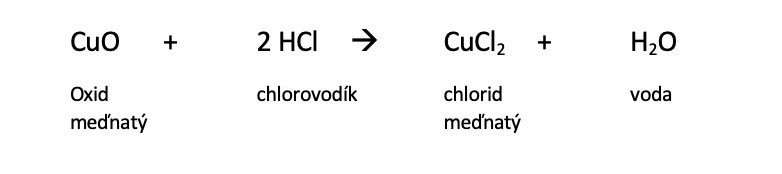
Na kousek hliníkové fólie či na kovové víko vysypte 1 lžíci chloridu amonného. Měděný drát uchopte pomocí držáku na zkumavky a jeho druhý konec držte nad plamenem lihového hořáku. Drát v plameni zčerná a vytvoří se na něm tenká vrstvička oxidu měďnatého (CuO). Ještě horký drát ponořte do chloridu amonného a následně ho opět vraťte nad plamen hořáku. Vrstvička oxidu zmizí, opět se objeví lesklá zářivá měď a plamen hořáku se na malou chvíli zbarví zeleně. Chlorid amonný: A1
Chlorovodík, vznikající při tepelném rozkladu chloridu amonného, se naváže na oxid měďnatý za vzniku chloridu měďnatého (CuCl2), který při odpařování zbarvuje plamen hořáku zeleně:
Plyn s ostrým zápachem
Experiment provádějte na vnějším prostranství nebo při otevřeném okně. Po dokončení pokusu místnost dobře vyvětrejte. Dodržujte pokyny týkající se doporučených množství jednotlivých látek potřebných k experimentu.
Amoniak je při vdechování toxický a může způsobovat vážné popáleniny kůže a poškození zraku. - Plyn nevdechujte. - V PŘÍPADĚ VDECHNUTÍ: Postiženého přesuňte ven z místnosti na čerstvý vzduch a udržujte jej v klidu a v poloze pohodlné pro dýchání. - V PŘÍPADĚ KONTAKTU S OČIMA: Oči opatrně oplachujte vodou po dobu několika minut. V případě, že má postižená osoba nasazeny kontaktní čočky, je, pokud je to možné, vyjměte. Pokračujte ve vyplachování. Okamžitě kontaktujte Národní kontaktní místo pro chemickou bezpečnost, případně zavolejte lékaře.
K oddělení plynného amoniaku od chlorovodíku nestačí tyto plyny jednoduše ohřát. Látka se totiž po ochlazení znovu zformuje do původní podoby. Aby se vám podařilo amoniak oddělit, musíte na vhodnou látku navázat chlorovodík vznikající při dekompozici chloridu amonného - například na hydroxid vápenatý, Ca (OH)2:
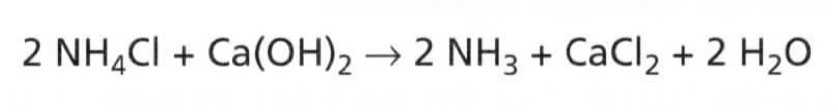
V případě, že by vám výše uvedený zápis připadal příliš komplikovaný, přepíšeme rovnici reakce následovně (NH3HCl ovšem není nic jiného než NH4Cl):
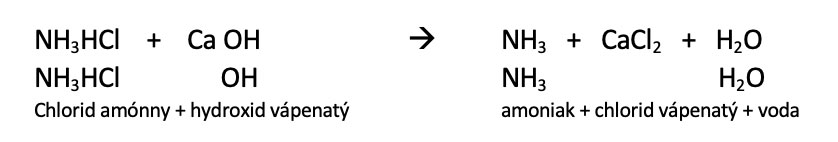
Věnujte pozornost poznámce vztahující se k hydroxidu vápenatému v sekci ,,Nebezpečné látky a směsi'', začínající na straně č. 7.
Experiment č. 151
Ve zkumavce smíchejte jednu lžíci chloridu amonného a jednu lžíci hydroxidu vápenatého. Zkumavku uzavřete zátkou (palcem zátku přidržujte na místě!) a jemně ji protřepejte. Zkumavku otevřete a opatrně k sobě rukou přivějte malý závan unikajících výparů. A2
Do nosu vás udeří vůně charakteristická pro některé čisticí prostředky. Proužek vlhkého červeného lakmusového papírku podržte na okraji otvoru zkumavky tak, aby se nedotýkal stěn. Proč se jeho barva změnila na modrou? Reaguje amoniak zásaditě?

Měď se při zahřívání pokryje vrstvičkou oxidu měďnatého; při zahřívání v přítomnosti chloridu amonného reaguje oxid měďnatý s chlorovodíkem za vzniku chloridu měďnatého, který zabarvuje plamen zeleně.

• Molekula amoniaku, NH3.

Moderní vysokotlaká pec na výrobu amoniaku. (Fotografie: Chemical Industry Fund)

Síran amonný - často používané hnojivo s obsahem dusíku. (Fotografie: BASF)
Technologie a životní prostředí - Dusík ze vzduchu
V moderní ekonomice hraje amoniak důležitou roli. Lidstvo by se nedostalo daleko, kdyby se s jeho výrobou spoléhalo na velbloudí či jiný zvířecí trus. Ve velkých množstvích je amoniak vyráběn pomocí vysokotlaké syntetické metody, jejímiž vynálezci jsou Carl Bosch (1874-1940) a Fritz Haber (1868-1934). Termín ,,syntéza'' označuje proces, při kterém dochází ke kombinaci a spojení počátečních materiálů vstupujících do reakce za vzniku nové látky.
Látkami, jež do reakce v případě syntézy amoniaku vstupují, jsou dva prvky: dusík a vodík. Dusík získáváme ze vzduchu, v němž je zastoupen přibližně 80 %.
Vodík je obvykle získáván konverzí metanového plynu (CH4) obsaženého v zemním plynu prostřednictvím vodní páry.
Reakce mezi dusíkem a vodíkem probíhá ve speciálních reaktorech při tlaku 200 až 300 barů (jinými slovy při tlaku 200-300x větším než atmosférický tlak) za přítomnosti katalyzátoru:
N2 + 3 H2 -> 2 NH3
Takovým způsobem vyrobený amoniak je následně oddělen z reakční směsi jejím zkapalňováním při vysokém tlaku. V chemickém průmyslu se amoniak mimo jiné používá k výrobě kyseliny dusičné, sody, sodného popela (vyráběného Solvayovým procesem) a solných hnojiv (síranu amonného).
Ne plyn, ale vodný roztok. Amoniak s vodou reaguje následovně:
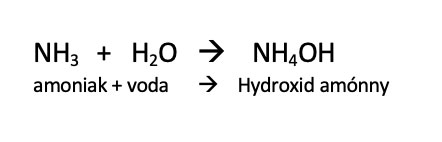
Hydroxid amonný je tvořen amonnými ionty NH4+ a hydroxidovými ionty OH-, které jsou zodpovědné za zásaditou reakci roztoku.
Vyrobme si amonný líh
Amonný líh představuje prchavou součást, kterou lze uvolnit z chloridu amonného tak, jak se vám to podařilo v rámci experimentu 151 s amonným plynem. V dnešní době, v rámci toho, do jaké míry se pojem ,,amonný líh'' používá, jím lidé označují vodný roztok amoniaku, také známý jako amonná voda. V následujících experimentech budete vyrábět roztoky obsahující amoniak.
Věnujte pozornost poznámce vztahující se k chloridu amonnému, hydroxidu vápenatému a uhličitanu sodnému v sekci ,,Nebezpečné látky a směsi'', začínající na straně č. 7.
Experiment č. 152
Do zkumavky obsahující 2 lžíce chloridu amonného a 2 lžíce hydroxidu vápenatého dolijte do výšky 4-5 cm vodu, zkumavku uzavřete zátkou (palcem ji svrchu přidržujte!) a její obsah protřepejte. Neprůhlednou, mírně kalnou kapalinu přefiltrujte do další zkumavky. Použijte dvojitou vrstvu filtračního papíru. Opatrně si přivoňte k hrdlu zkumavky (nenadechujte se zhluboka!). Typická vůně amoniaku! U otvoru zkumavky podržte proužek navlhčeného červeného lakmusového papírku tak, aby se nedotýkal stěn zkumavky. Jasné modré zbarvení papírku ukazuje na přítomnost těkavého amoniaku. Usazeniny: A2, filtrát: uschovejte na experiment 153, usazenina: A2.
Otázka č. 31: Proč by se lakmusový papírek neměl dotknout stěn zkumavky?
Experiment č. 153
Část filtrátu získaného v experimentu 152 rozpusťte v pětinásobném objemu vody a do vzniklého roztoku přidejte trochu roztoku uhličitanu sodného. Ve zkumavce vám vznikne bílá usazenina. Otestujte, jak bude reagovat, když k ní přidáte trochu octa. A2
Roztok z experimentu 152 obsahuje amoniak, avšak není jeho čistým roztokem. Tak, jak reakční rovnice na straně 79 indikuje, roztok obsahuje i vedlejší produkt chlorid uhličitý, který v roztoku uhličitanu sodného vytváří sraženinu uhličitanu vápenatého. Uhličitan vápenatý je rozpustný v kyselině octové.
Experiment č. 154
Opakujte postup uvedený v popisu experimentu 152, namísto hydroxidu vápenatého však použijte uhličitan sodný. Tentokrát čirý roztok získáte okamžitě a filtraci nebudete potřebovat. Získaný roztok uschovejte pro další experimenty.
Modrý neviditelný inkoust
Věnujte pozornost poznámce vztahující se k síranu měďnatému v sekci ,,Nebezpečné látky a směsi'', začínající na straně č. 7.
Experiment č. 155
Dodatečné materiály a pomůcky: pero s ocelovým hrotem nebo jemný, tenký umělecký štětec
1 lžíci síranu měďnatého rozpusťte v objemu vody dosahujícím do výšky 3 cm a výsledný bleděmodrý roztok použijte jako neviditelný inkoust na napsání vzkazu, ideálně na světle modrý papír. K tomu, abyste si napsanou zprávu mohli opět přečíst vy nebo adresát tohoto tajného odkazu, použijte amoniakální roztok, který jste si odložili po dokončení procházejícího experimentu. Roztokem namočte kousek filtračního papírku (tak, že na něj pomocí pipety kápnete několik kapek roztoku), přiložte jej na papír, na který jste napsali tajný odkaz, a přitiskněte. Písmena se zbarví jasně modrou barvou. A2, A3
Modrou barvu písmen má na svědomí sloučenina mědi a amoniaku, se kterou se opět setkáte v kapitole 13.
Prchavá sůl
Možná jste ve starých filmech z dřívějších dob viděli scény, ve kterých bylo dámy a slečny třeba křísit poté, co byly vlivem kouzla vonných solí uvrženy do hlubokého spánku. Takové soli, které byly často známé pod vtipně znějícím názvem ,,jelení sůl'', však nejsou z chemického hlediska ničím jiným než uhličitanem amonným a/nebo bikarbonátem amonným, které se v Evropě dodnes používají jako kypřidlo při přípravě vánočních perníků. ,,Jelení sůl'' můžete dodnes nalézt v některých specializovaných obchodech (pravděpodobně pod názvem Hirschhornsalz či Salajka).
Věnujte pozornost poznámce vztahující se k jelení soli v sekci ,,Nebezpečné látky a směsi'', začínající na straně č. 7.
Experiment č. 156
Do zkumavky nasypte 2 lžíce ,,jelení soli'' a velmi opatrně ji zkuste očichat (trošku si přivoňte k obsahu zkumavky). Do nosu vás udeří vůně amoniaku, která může být o to slabší, čím déle byl produkt v nádobce uložen. Pro srovnání zkuste očichat i lahvičku obsahující chlorid amonný. V tomto případě neucítíte známý zápach amoniaku. To, že je amoniak v ,,jelení soli'' vázán mnohem slaběji než v chloridu amonném, je možné pozorovat i srovnáním různých hodnot pH vodných roztoků těchto dvou látek.
Experiment č. 157
Do jedné zkumavky nasypte 1 lžíci ,,jelení soli'' a do druhé zkumavky dejte 1 lžíci chloridu amonného. Každou ze zkumavek doplňte do výšky 5 cm vodou. Oba připravené roztoky doplňte pomocí pipety roztokem anthokyanu. Chlorid amonný zabarví anthokyanový roztok na světle fialovou barvu, zatímco ,,jelení sůl'' jeho barvu změní na sytě zelenou. Chlorid amonný vykazuje mírně kyselou reakci, zatímco ,,jelení sůl mírně zásaditou.

Výroba amoniaku ze zvířecích kostí - od dob starověkého Egypta se sotva něco změnilo; ze Stockhardtu, Školy chemie (1863).

Poznámky pod čarou
Jelení sůl
Možná jste již slyšeli o alchymistech, předchůdcích dnešních chemiků. I když se jim nedařilo proměňovat základní kovy na zlato, učinili mnoho velmi důležitých objevů v oblasti chemických látek. Sůl, kterou se jim podařilo vyrobit zahříváním zvířecích zbytků -například parohů, rohů, kopyt či drápů - obsahujících bílkoviny, byla velmi vzácná, vážená a využívaná pro lékařské účely. Obzvlášť působivé bylo, že se sůl už při pokojové teplotě stávala těkavou a uvolňovala při tom amoniak či jiné plyny, které jej obsahovaly. Sůl pojmenovali alkali Volubilis čili prchavá zásada.
V dnešní době je uhličitan vápenatý, jenž je těkavou složkou ,,jelení soli'', vyráběn zahříváním směsi síranu amonného a uhličitanu vápenatého. Nepoužívá se jen jako kypřidlo při pečení, ale i k mnohým jiným účelům, např. v náplni do hasicích přístrojů.
Experiment č. 158
Předchozí experiment zopakujte, avšak jako indikátor použijte lakmusový roztok (do každé ze zkumavek ho přidejte několik kapek). Roztok chloridu amonného se zbarví načervenale fialově (mírně zásaditě), zatímco roztok ,,jelení soli'' se zbarví modře (zásaditě). A1
Věnujte pozornost poznámce vztahující se k hydroxidu vápenatému a vápenné vodě v sekci ,,Nebezpečné látky a směsi'', začínající na straně č. 7.
Při zasouvání zahnuté skleněné trubice do zátky buďte opatrní! Přečtěte si bezpečnostní informace uvedené na stránkách 13/14. V případě, že došlo ke zranění: První pomoc 7 (vnitřní strana přední obálky).
Experiment č. 159
Do výšky 3 cm ve zkumavce nalijte vápennou vodu a zkumavku umístěte do stojanu. Kratší rameno zahnuté trubice zasuňte do gumové zátky. Do druhé zkumavky přidejte 2 lžíce ,,jelení soli'' a do výšky 2 cm zkumavku naplňte octem. Ve chvíli, kdy pěna přestane stoupat, zkumavku uzavřete zátkou a volný konec zahnuté trubice ponořte do vápenné vody. Nedovolte však, aby se pěna či kapalina prostřednictvím zahnuté trubice dostala do kontaktu s vápennou vodou. Vznik bílé sraženiny indikuje přítomnost oxidu uhličitého. A1
,,Jelení'' sůl obsahuje obojí - amoniak i oxid uhličitý. Není jednoduchou látkou, ale sloučeninou více materiálů - směsí. Většinou je z jedné části tvořena uhličitanem amonným (NH4) 2CO3 a ze dvou částí hydrogenuhličitanem amonným NH4HCO3.
Experiment č. 160
Do suché zkumavky přidejte 2 lžíce ,,jelení soli'' a zahřejte ji nad plamenem lihového hořáku. Hrdlo zkumavky nad plamenem držte mírně nakloněné. Kolem chladnějšího otvoru zkumavky se opět vytvoří kondenzované kapky vody, ovšem solný povlak jako v případě chloridu amonného nevznikne. Sůl se nakonec odpaří poté, co projde kompletní proměnou a rozkladem na amoniak, oxid uhličitý a vodu. Jinými slovy vznikají jen plyny. I voda se při teplotách nad 100 °C stává plynem. ,,Jelení sůl'' tak perfektně splňuje požadavky na kypřidlo používané při pečení koláčů - těsto zjemňuje a kypří díky produkci plynů.
