V kapitole 3 jste se dozvěděli o dvou způsobech separace jednotlivých složek směsí: o dekantaci (usazování) a sublimaci (odpařování). V této kapitole si vyzkoušíte i jiné metody používané odborníky k separaci složek směsí.
Filtr z papíru
Při použití metody dekantace (usazování) nelze zcela oddělit kapalinu od sedimentu (usazeniny). Jde to lépe filtrací. K tomu použijete filtrační papír, který funguje jako jemné síto. Póry papíru jsou dostatečně velké, aby umožnily kapalině protéci, avšak pevné částice, pokud nejsou také tak malé, aby papírem protekly, jsou zadržovány.
Kolečko filtračního papíru složte podél červených vyznačených čar tak, jak vidíte na ilustracích vpravo. Vznikne vám kuželovitý útvar sestávající z jedné vrstvy filtračního papíru na jedné straně a tří vrstev na straně druhé. Kužel vložte do nálevky (trychtýře) a jemně ho navlhčete vodou tak, aby se papír přilepil ke stěnám nálevky. Trychtýř vložte do prázdné zkumavky.
Experiment 19
Do zkumavky nasypte 2 plné lžíce písku a doplňte ji do poloviny vodou. Obsah zkumavky pořádně protřepejte a přes filtrační papír jej přelijte do prázdné zkumavky. Čistá kapalina tekoucí do zkumavky - v tomto případě voda - se nazývá filtrát. Písek zůstává zachycen na povrchu filtračního papíru. A1, A3
Písek je tvořen drobnými krystalky křemene. Ty jsou ve vodě nerozpustné a jsou relativně těžké, takže po nasypání do vody klesnou na dno. Zrnka křemene jsou také příliš velká na to, aby pronikla přes otvory ve filtračním papíře, který plní funkci extrémně jemného síta.
Experiment 20
Směs 1 lžíce písku a kuchyňské soli v 10 ml vody přefiltrujte. Filtrát uschovejte pro další experiment.
V případě denaturovaného alkoholu a kyseliny chlorovodíkové si pozorně přečtěte informace v kapitole "Nebezpečné látky a směsí" na str. 7-9.
Testování na chlorid dusičnanem stříbrným
V předchozím experimentu jste vyrobili roztok kuchyňské soli, když jste oddělili písek a sůl. Abyste dokázali, že pracujete s roztokem soli, nemusíte nutně použít metodu odpařování. Použijete činidlo: roztok dusičnanu stříbrného. Jelikož roztok dusičnanu stříbrného je drahý a škodlivý pro životní prostředí, budete muset s obsahem lahvičky zacházet šetrně. Dbejte na dodržení uvedených hodnot a činidlo přidávejte po kapkách.

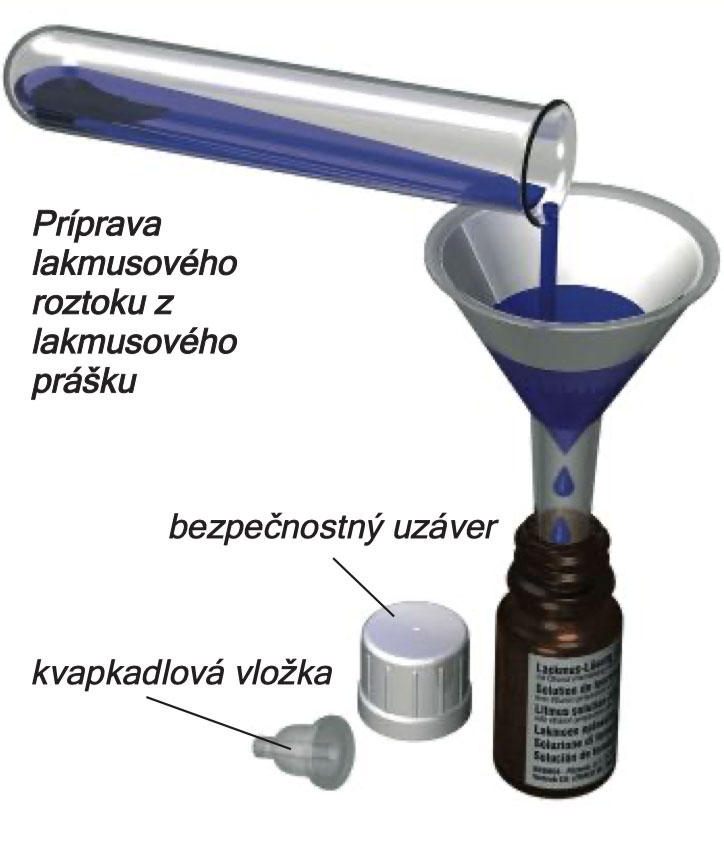
Výroba lakmusového roztoku
Vaše experimentální sada C3000 obsahuje lakmusový prášek, ze kterého si vyrobíte tmavomodrý lakmusový roztok. Jako součást experimentů, které vás čekají, budete používat a pracovat s tímto roztokem nebo s proužky filtračního papíru saturovaných lakmusovým roztokem: lakmusový papírek.
Lakmusový prášek není tvořen jen jedním druhem materiálu. Je směsí přísad pocházejících z různých rostlin známých jako lišejníky. Lakmusový roztok vydrží jen určitou dobu a v případě, že ho uskladňujete příliš dlouho, se může jeho vůně změnit (suchý prášek má zemitou vůni). Množství prášku, které najdete v balení soupravy, by mělo být dostačující k přípravě tří dávek lakmusového roztoku. Na jednu dávku použijte 3 malé rovné lžičky lakmusového prášku. Ty nasypte do zkumavky, přidejte objem vody, který bude sahat do výšky 3 cm, zkumavku uzavřete a obsah v ní protřepejte. Zavřenou zkumavku nechte den odstát na bezpečném místě mimo dosah malých dětí.
Jako další krok umístěte trychtýř s filtračním papírem uvnitř do nádobky označené ,,lakmusový roztok''. Obsah zkumavky po odstání přelijte do nádobky přes filtrační papírek. Usazenina, která zůstane ve zkumavce a na filtračním papíru, může být bezpečně vyhozena do komunálního odpadu.
Životnost lakmusového roztoku můžete prodloužit přidáním poloviny pipety denaturovaného alkoholu. Poproste svého dospělého pomocníka, aby vám s tímto krokem pomohl. Lahvičku uzavřete bezpečnostním uzávěrem - kapátko se zasune do hrdla lahvičky. K tomu, abyste mohli do lahvičky roztok po spotřebování doplnit, bude nutné nejprve odstranit kapací vložku (poproste dospělou osobu o pomoc). Ilustrace na obrázcích nalevo vám napovídají, jak bezpečnostní uzávěr otevírat a zavírat současným zatlačením dolů a otáčením. Nyní už je váš lakmusový roztok hotový a připravený k použití. Pokyny k výrobě lakmusových papírků najdete uvedeny těsně před popisem experimentu 45.

Stříbro
Stříbro, chemická značka Ag (lat. Argentum), je ušlechtilý kov bílé barvy, používaný člověkem již od starověku. Vyznačuje se nejlepší elektrickou a tepelnou vodivostí ze všech známých kovů. Slouží jako součást různých slitin. Je vhodné pro použití v elektronickém průmyslu, při výrobě CD i DVD nosičů a ve šperkařství. Jeho sloučeniny jsou potřebné pro fotografický průmysl.
Více informací najdete na Wikipedii zde.

V případě roztoku dusičnanu stříbrného si pozorně přečtěte informace o nebezpečných látkách a směsích na str. 7-9.
Experiment 21
Přidejte 5 kapek roztoku dusičnanu stříbrného do 2 ml filtrátu z experimentu 20. Získáte bílou sraženinu. A10
Sraženina označuje kyselinu chlorovodíkovou a chlorid (více v kapitole 10). Hlavní složkou kuchyńské soli je chlorid sodný.
Pokud je vaše voda z vodovodu "tvrdá" (zeptejte se rodičů), měli byste na experimenty s roztokem dusičnanu stříbrného použít destilovanou (demineralizovanou) vodu. Minerály obsažené v tvrdé vodě mohou totiž také produkovat sraženiny.
Skupenství látek
Pravděpodobně víte, že voda se vyskytuje se ve třech základních formách:
led - pevné skupenství
voda - kapalné skupenství
pára - plynné skupenství.
I jiné látky se mohou vyskytovat v těchto třech základních skupenstvích, a to v závislosti na převládajících podmínkách, zejména na teplotě a tlaku.
Má-li voda teplotu nižší než 0 °C, za normálního tlaku (u zemského povrchu) je pevná, v rozmezí 0 až 100 °C je kapalná a při 100 °C začne vřít a prudce se měnit na plyn. Voda se vypařuje při nižší teplotě, dokonce se může odpařovat přímo z ledu - tento jev nazýváme sublimace. Když v zimě pověsíte na balkón mokré prádlo a teplota je pod bodem mrazu, voda v prádle zmrzne, ale po čase se z něj voda vypaří, pokud jsou k tomu vytvořeny vhodné podmínky (vzduch je dostatečně suchý a fouká vítr). Voda také může vřít při mnohem nižší teplotě než 100 °C, a to při klesajícím tlaku vzduchu. Například na nejvyšší hoře světa Mt. Everestu voda vře při teplotě 70 °C, protože je tam mnohem méně vzduchu (a tedy nižší tlak vzduchu) než u zemského povrchu.
To, co jsme ukázali na příkladu vody, platí i pro většinu ostatních látek. Při dostatečně vysokých nebo nízkých teplotách se mohou objevit ve všech třech skupenstvích. Železo taje při teplotě 1 535 °C a odpařuje se (mění na plyn) při teplotě okolo 2 750 °C.
Částice látky jsou v neustálém pohybu. V pevném stavu (krystalová mřížka) je jejich kinetická (pohybová) energie nízká. Částice jen vibrují kolem svých rovnovážných poloh. Když se teplota zvýší, tj. je dodána energie, molekuly vibrují silněji a narážejí do sebe. Zahřívaný materiál expanduje - zvětšuje se. Další zahřívání zvyšuje kinetickou energii částic tak, že opouštějí své rovnovážné polohy, krystalová mřížka se vlivem gravitace zhroutí: materiál se taví, ale většina částic zůstává pohromadě, protože nedokážou překonat gravitační působení a vzájemnou přitažlivost. Když se teplota dále zvýší, molekuly získají takovou rychlost, že některé z nich překonají sílu vzájemné přitažlivosti i gravitační sílu a poletují po místnosti či nádobě všemi směry - látka se odpaří.

Experiment 22
Odpařovací misku s několika kapkami vody položte na suché místo. Voda se po chvíli odpařila.
Skutečnost, že vodní pára zabírá mnohem více místa než odpovídající množství vody v kapalném skupenství, je demonstrována v následujícím experimentu.
Při manipulaci se skleněnými zkumavkami buďte opatrní. Přečtěte si informace na str. 15. V případě zranění: První pomoc 7 (uvnitř předního obalu).
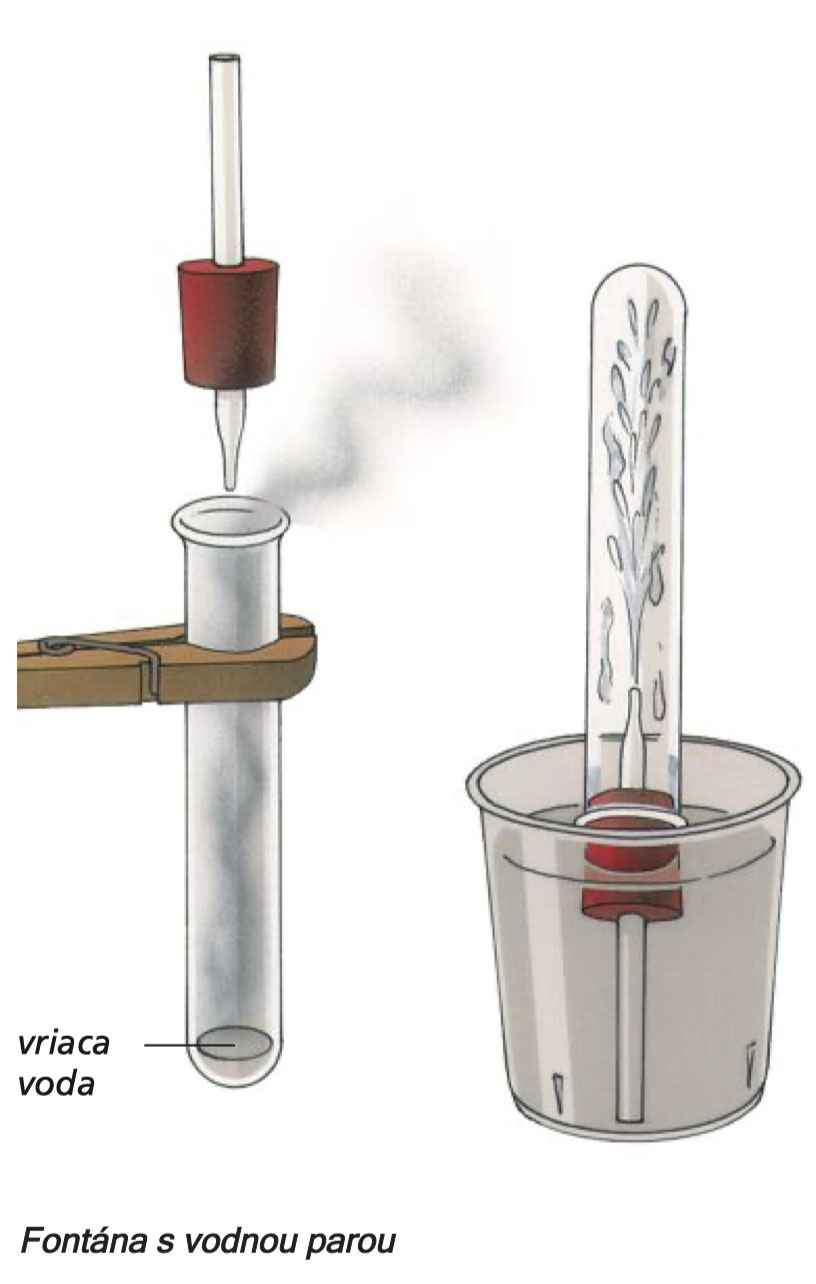
Experiment 23
Špičatou skleněnou trubici zasuňte do zátky tak, jak je znázorněno na obrázku. Zkumavku upněte do držáku, nalijte do ní trochu vody a přiveďte k varu. Rychle nasuňte na hrdlo zkumavky zátku se špičatou trubicí a vložte dnem vzhůru do kádinky s vodou. Voda vystoupá do skleněné trubice, vstříkne vodu do zkumavky a do poloviny ji zaplní vodou.
Co se stalo? Vodní pára ve zkumavce se rychle ochlazuje. Část páry se při tomto ochlazení opět změní na vodu. Tento proces, který se po sprchování odehrává na každém koupelnovém zrcadle, se nazývá kondenzace. Kondenzovaná voda potřebuje ve zkumavce méně místa než vodní pára, proto je vzduch ve zkumavce řidší - je tam nižší tlak, a proto tlak vzduchu mimo zkumavku vtlačí vodu z kádinky do zkumavky.
Experiment 24
Do malé nádoby od zavařeniny přidejte směs 30 g kuchyňské soli a 90 g sněhu nebo práškového ledu (odvažte kuchyňskou váhou). Vložte zkumavku s několika mililitry vody do mrazicí směsi. Po několika minutách voda ve zkumavce zamrzne. Tento druh směsi ledu a solí (budete se učit o jiných solích než o kuchyňské) můžete využít k vytvoření teploty až -55 °C.
S kuchyňskou solí vytvoříte nejnižší teplotu -20 °C.
Jak můžeme vysvětlit chladicí efekt? Rozpuštění soli a roztátí ledu vyžadují energii, která je odebrána ze směsi. Toto odebrání energie se projeví ochlazením.

Tlak uvnitř propanové nádrže je 24násobkem normálního tlaku vzduchu.
Experiment 25
Do Erlenmeyerovy baňky nalijte asi 20 ml vody, baňku upevněte do držáku na zkumavky, položte na stojan hořáku s drátěným pletivem a obsah přiveďte k varu. Voda opravdu musí bublat. Odeberte baňku z plamene, utěsněte ji gumovou zátkou a podržte ji pod studenou tekoucí vodou. Obsah baňky opět začne vřít.
Jak jste viděli v pokusu 23, vodní pára kondenzuje na vodu, když je ochlazena. Tím vzniká v baňce nižší tlak, protože vzduch je řidší, a tyto podmínky snižují teplotu varu. Podtlak je také zjevný, chcete-li z baňky odstranit zátku. S tímto vám může pomoci dospělá osoba.
Můžete také zvýšit teplotu varu (a udržet tak látku v kapalném skupenství) zvýšením tlaku. Toto je technika používaná ke zkapalňování plynů. Propan má teplotu varu -45 °C, což znamená, že nad touto teplotou je plynný. Použitím tlaku se může teplota varu propanu zvýšit tak, že je kapalný i při teplotě místnosti. V ocelových nádobách, ve kterých se prodává jako "kapalný propan", je tlak přibližně 24 500 hPa - přibližně 24-násobek normálního tlaku vzduchu.
Chemická fakta
Nižší tlak vede k nižšímu bodu varu. Vyšší tlak vede k vyššímu bodu varu.
Domácí destilovaná voda
Jedna z pracovních technik, při níž odpařování a kondenzace jdou spolu ruku v ruce, je známá jako destilace (latina destillare = odkapávání), která se mimo jiné využívá k oddělování kapalných a pevných látek.
V případě síranu amonno-železitého a roztoku dusičnanu stříbrného si pozorně prostudujte informace o nebezpečných látkách a směsích na str. 7-9. Při manipulaci se skleněnými zkumavkami buďte opatrní. Přečtěte si informace na str. 15. V případě zranění: První pomoc 7 (uvnitř předního obalu).
Experiment 26
Do Erlenmeyerovy baňky přidejte 30 ml vody spolu s 1 malou lžičkou síranu amonno-železitého a 1 malou lžičkou kuchyňské soli. Asi 5 ml roztoku otestujte roztokem hexakyanoželeznatanu draselného (II) na přítomnost železa, jak bylo uvedeno v experimentu 15. Do 2 ml roztoku přidejte 5 kapek roztoku dusičnanu stříbrného na otestování přítomnosti chloridu. Tyto rozpuštěné látky se v roztoku projeví modrou nebo bílou usazeninou. A1, A10
Sestavte experimentální aparaturu, jak je to znázorněno na obrázku (nezapomeňte na skleněné kuličky nebo k eliminaci bouřlivého varu upřednostněte kameny), a obsah baňky přiveďte k varu. Pára unikne ze sestupující skleněné trubice a část z ní kondenzuje na čistou kapalinu ve zkumavce chlazené vodou. Vaše destilační aparatura není moc efektivní, protože výtěžek z kondenzace - kondenzát nebo destilát - je malý.
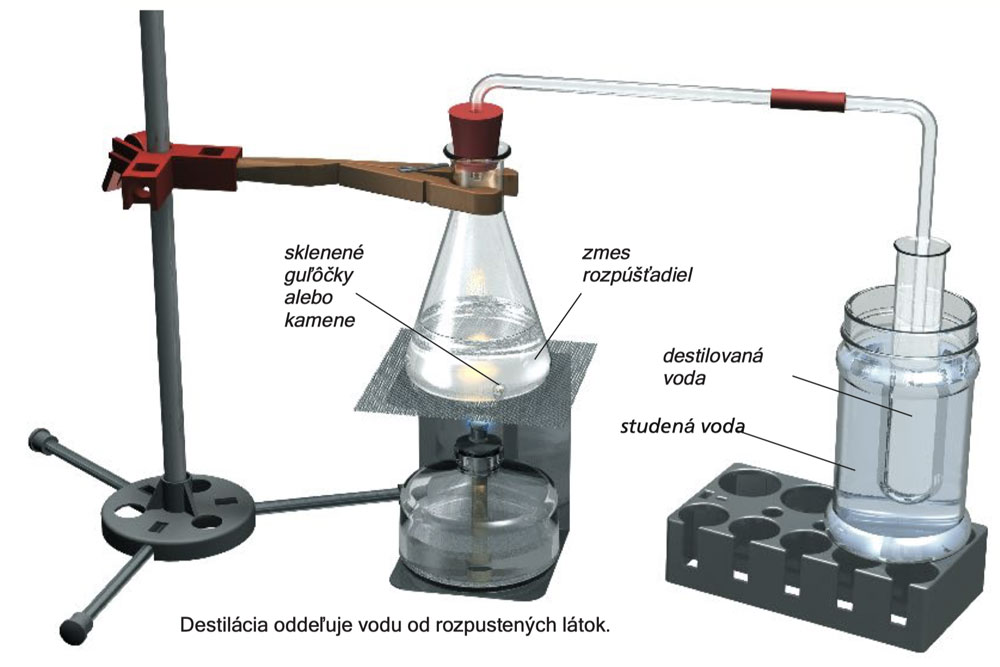
Experiment 27
Testujte 5 ml a 2 ml destilátu na přítomnost železa a chloridu, jak je popsáno výše. Vzorky budou negativní. A1, A10
Destilát je bez přísad. Je to prostě jen destilovaná voda. V laboratoři se používá destilovaná voda (také známá jako demineralizovaná voda), protože voda z vodovodu obsahuje minerály, které mohou nechtěně ovlivňovat zkoumání chemické reakce.
Takže k oddělení rozpouštědla od rozpuštěných látek můžete použít destilaci v případech, kdy tyto rozpuštěné látky mají mnohem vyšší teplotu varu než rozpouštědlo. Obecně jde o pevné látky. Po zahřátí rozpouštědlo přechází do plynného stavu, zatímco rozpuštěné látky (jako jsou síran amonno-železitý a kuchyňská sůl) zůstávají v Erlenmeyerově baňce.
Experiment 28
Udělejte zkoušku obsahu baňky na železo roztokem hexakyanoželeznatanu draselného (II). A1
Experiment 29
Do 2 ml obsahu baňky přidejte 5 kapek roztoku dusičnanu stříbrného. A10
Jak vidíte, rozpuštěné látky zůstaly v baňce.
Chcete-li při procesu destilace získat odpařené látky, můžete vzniklou páru chladit účinnými vodními chladiči. Pokud na druhé straně chcete oddělit rozpuštěnou látku, můžete to udělat v mnoha případech jejím povařením. V tomto procesu obsah rozpuštěné látky v roztoku stoupá až do úplného odpaření rozpouštědla.

Destilace v chemické laboratoři. Odpařovací baňka naplněná žlutou kapalinou se otáčí ve vyhřívané lázni. Stoupající páry kondenzují na chladnějších skleněných cívkách, kterými prochází studená voda. Bezbarvý destilát se sbírá ve sběrné baňce.
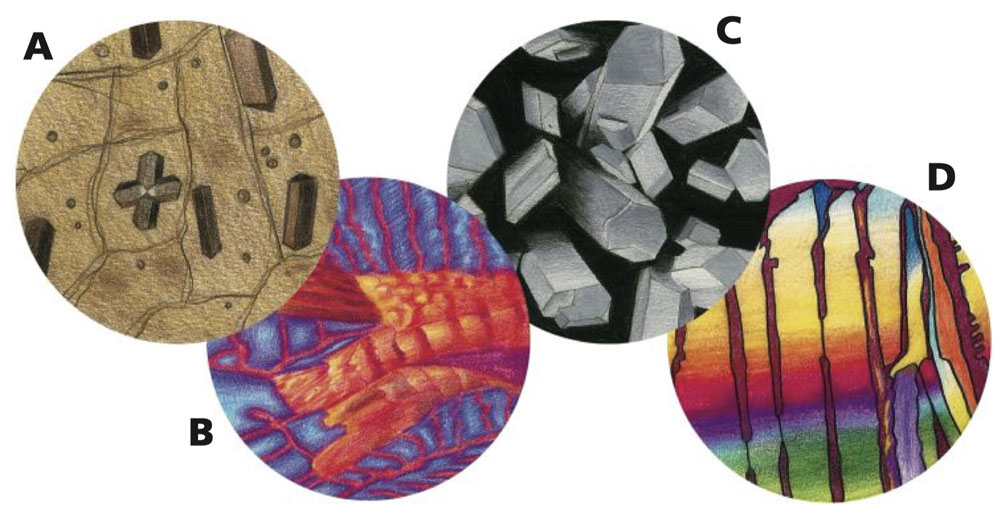
Krystaly skrze objektiv mikroskopu (a pod polarizovaným světlem)
A krystaly v hnědé cibulové slupce
B krystaly aspirinu
C krystaly vitaminu C
D krystaly cukrové řepy

Krystalizátory pro roztoky obsahující sůl. (Foto: Lurgi)
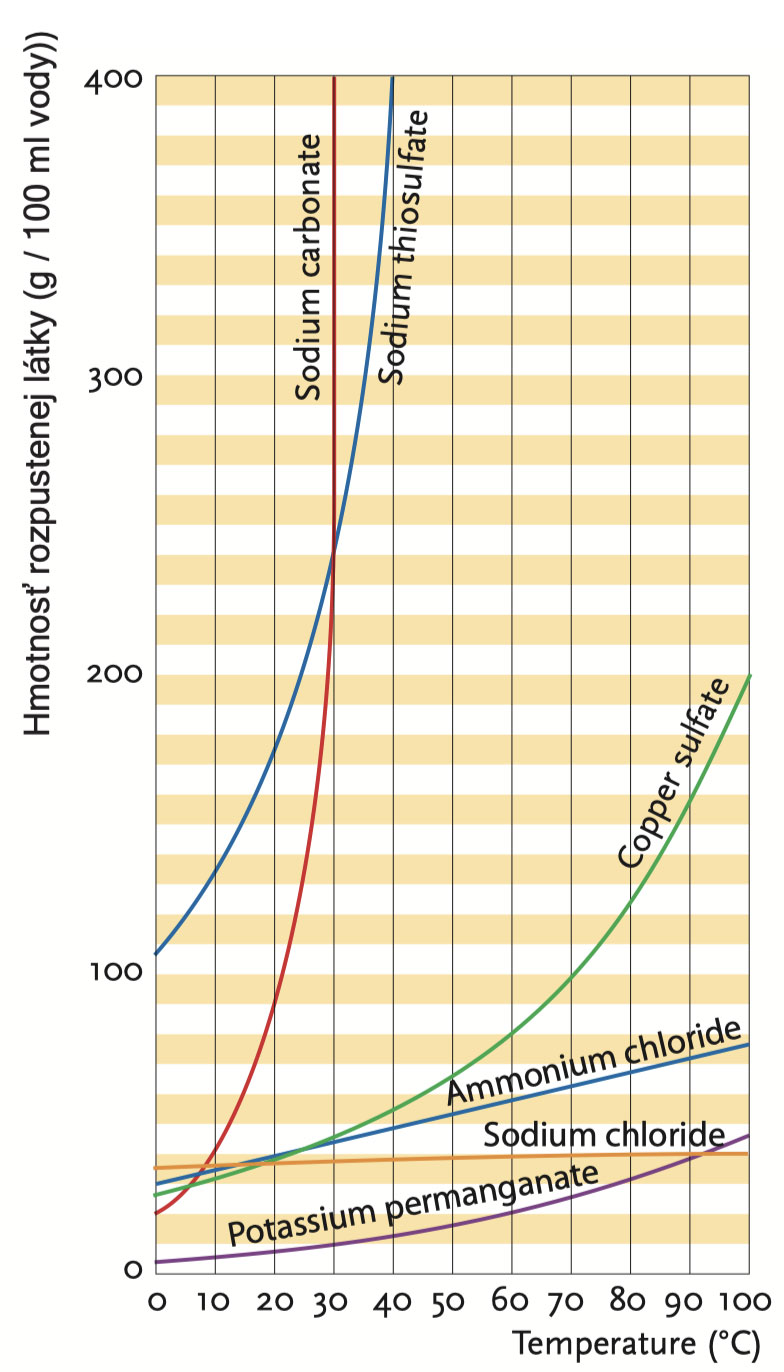
Křivky rozpustnosti několika solí. 100 ml vody rozpustí 400 g thiosíranu sodného při 40 °C; když se zahřeje z 0 na 100 °C, rozpustnost kuchyňské soli se téměř vůbec nezmění.
Oddělování krystalizací
V následujícím textu budeme používat pojem krystalizace pro označení oddělování krystalů z vodných roztoků (na bázi vody). Krystalizace je užitečným separačním a čisticím procesem, protože většina nečistot zůstává rozpuštěná v původním roztoku nebo v "mateřském roztoku", zatímco látka, která vykrystalizovala, vykazuje vyšší stupeň čistoty. Jako proces čištění však ponecháme krystalizaci profesionálům. Budete provádět několik jednoduchých pokusů, abyste se dozvěděli více o metodách tvorby krystalů, stejně tak abyste získali nějaké zkušenosti s nasycenými a nenasycenými roztoky.
Při krystalizaci z vodných roztoků můžeme rozlišovat tři metody:
1. Krystalizace ochlazením horkého nasyceného roztoku
2. Krystalizace redukcí množství rozpouštědla (odpaření, var)
3. Krystalizace přidáním třetí látky se změnou poměrů rozpustnosti
Který postup v daném případě použijete, závisí na tom, jak se změní rozpustnost krystalického materiálu s teplotou. Rozpustností nebo koncentrací nasycení se rozumí množství látky (v gramech), které se při dané teplotě rozpustí ve 100 ml roztoku. Roztok, jenž obsahuje takové množství látky při daných podmínkách, že už se látka dále nerozpouští, se nazývá nasycený roztok. Roztok, který obsahuje méně látky nebo je schopen více rozpustit, se nazývá nenasycený roztok.
Krystalizace chlazením
V případě chloridu amonného si pozorně přečtěte informace o nebezpečných látkách a směsích na str. 7-9.
Experiment 30
Do zkumavky vlijte 1 až 2 ml vody a přidejte 2 lžíce chloridu amonného. Zkumavku uzavřete zátkou a protřepejte. Chlorid amonný se rozpustí; roztok je nenasycený. Nyní postupně přidávejte více chloridu amonného a po každé lžíci promíchejte. Až sediment zůstane i po promíchání, roztok je nasycený. Zkumavku zahřejte. Sediment se rozpustí. Takže rozpustnost chloridu amonného stoupá se zvyšující se teplotou.
Zkumavku držte pod studenou tekoucí vodou. Bílé krystaly se z roztoku oddělí a chlorid amonný je zpět. A1
Jednoduchý příklad: pokud se 75 g chloridu amonného rozpustí ve 100 ml vody při 100 °C, avšak pouze 35 g při 20 °C, kdy se roztok ochladí ze 100 °C na 20 °C, pak 75 g - 35 g = 40 g látky z ní vykrystalizuje. Pro chlorid amonný je pak správný způsobem krystalizace krystalizace chlazením.
Když zahřívání nepomůže
Experiment 31
Vlijte do zkumavky 5 ml vody a přidejte kuchyňskou sůl, dokud se nevytvoří sediment, který nezmizí ani po důkladném protřepání, což znamená, že roztok je nasycený. Zkumavku zahřejte. Sediment zůstává.
Chlorid sodný, hlavní složka kuchyňské soli, je látka, jejíž rozpustnost se při zahřívání sotva zvyšuje. Metoda 1 tedy nebude fungovat, ale metody 2 a 3 ano.
Experiment 32
Nalijte trochu nasyceného roztoku kuchyňské soli do odpařovací misky a nechte roztok odpočívat na teplém a suchém místě (misku označte poznámkou "roztok kuchyňské soli"). Rozpouštědlo - voda - se bude postupně odpařovat a zůstanou krystaly soli.
V případě denaturovaného lihu si pozorně přečtěte informace o nebezpečných látkách a směsích na str. 7-9.
Požádejte dospělou osobu, aby vám pomohla nalít požadované množství alkoholu.
Experiment 33
Z nerozpuštěného sedimentu vylijte zbytek roztoku kuchyňské soli. Pipetou přidejte denaturovaný alkohol. Alkohol nechte pomalu stékat po stěně zkumavky do roztoku kuchyňské soli. Kde se solný roztok a alkohol setkají, vytvoří se bílý oblak. Zkumavku trochu protřepejte a pozorně sledujte. Z oblaku uvidíte padat malé krystaly. A1
Kuchyňská sůl je v ethanolu (hlavní složka denaturovaného alkoholu) prakticky nerozpustná. Na hranici, kde se roztok soli a alkoholu dotýkají, dochází k míchání obou kapalin, což vede k poklesu rozpustnosti kuchyňské soli: z roztoku se odděluje další sůl.
Oddělování na filtračním papíru
Pro následující experimenty bude nejdříve nutné zhotovit separační komoru. Podívejte se na ilustraci vpravo a uvidíte, co musíte udělat. Vložte malý drátěný háček (který můžete vyrobit narovnáním kancelářské sponky) do kousku korku a připevněte korek na víko nádoby.
Experiment 34
Dodatečný materiál: značkovače - fixy
Nyní se chystáte uspořádat závody barev značkovacích fixů. Vystřihněte 3 cm široký proužek filtračního papíru, dostatečně dlouhého na to, aby se při zavěšení na drátěný hák dostal několik milimetrů nade dno nádoby. Proužek položte na čistý povrch a nakreslete tužkou "startovní čáru".
Asi 1 cm od spodního okraje pásu vyznačte fixy body různých barev (průměr bodů by měl být přibližně 2 mm).
Nalijte do nádoby asi půl centimetru vody, zavěste připravený proužek na háček a našroubujte víko na nádobu. Pokud jste udělali vše správně, dolní okraj proužku by se měl ponořit do vody. Barevné body by ale neměly být pod vodou.
Nyní sledujte závody barev. Některé se pohybují tak rychle jako voda, zatímco jiné jsou pomalejší. Nejzajímavější ze všeho je, že budete vědět, zda dané pero obsahuje jednu barvu, nebo kombinaci barev. Fialová je často směsí červené a modré, zelená se může ukázat jako směs modré a žluté. Barvy se oddělují na filtračním papíru. Výsledek tohoto druhu separace je znám jako chromatogram.
Experiment 35
V posledním experimentu voda působila jako rozpouštědlo, které má v této technice speciální název mobilní fáze. Předchozí pokus opakujte, ale tentokrát použijte jako mobilní fázi směs 4 ml vody a 3 ml denaturovaného alkoholu. Postřehli jste rozdíl? A1

Poznámky pod čarou
Od barevných vzorů po chromatografii
Experimenty jako ty, které jste právě realizovali, byly poprvé provedeny před více než 150 lety. Chemika Friedlieba Ferdinanda Rungeho (1794-1867) fascinovaly barevné reakce na filtračním papíru. Pro něj to však bylo méně záležitostí oddělování látek, více to pojímal jako umění, protože své studie publikoval jako inspirace pro ilustrátory, malíře a návrháře tkanin.
Papírová chromatografie (řecky Chromos = barva), kterou vyvinuli angličtí výzkumníci během druhé světové války (1939-1945), slouží k analytickým účelům. Tato metoda využívá jako mobilní fázi speciální filtrační papírky, jakož i organická rozpouštědla nebo směsi rozpouštědel. Vzdálenosti, které testované látky překonávají, se určují způsoby, kterými se látky dělí mezi filtračním papírem obsahujícím vodu a rozpouštědly vystupujícími z papíru.
Od té doby byla papírová chromatografie překonána tenkovrstvou chromatografií, která namísto filtračního papíru používá plastové fólie potažené absorpčními materiály. Základní princip je stejný, avšak technika tenké vrstvy je mnohem efektivnější než starší metoda.


Obrázek 1: Závody barev fixů - voda.
Obrázek 2: Závody barev fixů - směs vody a alkoholu v poměru 4: 3.
Obrázek 3: Ať už jednotlivě, nebo společně, každá barva cestuje určitou vzdálenost.
Závody barev
Experiment 35
Vyberte dvě stejné barvy, které urazily různé vzdálenosti. Udělejte jednu tečku (obrázek 3 výše) v bodě 1 startovní čáry s barvou A a jednu v bodě 3 s barvou B a v bodě 2 aplikujte směs obou barev (jedna po druhé). Jako mobilní fázi použijte vodu nebo směs vody a alkoholu. Kombinované barvy (bod 2) se oddělí a uvidíte, že barevné složky se pohybují přesně tak daleko jako nesmíchané barvy, které se pohybují vedle nich. (bod 1 a 3) A1
Pokud máte neznámou směs, v níž je podezření na identitu jedné nebo druhé složky, můžete nechat tyto komponenty běžet vedle sebe, a tak na první pohled uvidět, zda jsou ve směsi přítomny.
Chemická fakta
Chromatogramy poskytují informace o různých barevných složkách směsi látek. I bezbarvé látky se mohou oddělit, pokud se vyrobí tak, aby produkovaly charakteristické barvy použitím vhodných činidel.
