Atomy a molekuly
Během experimentů spojených s rozpouštěním materiálů či zpětnou krystalizací látek z roztoků rozpuštěných materiálů jsme použili výraz ,,nejmenší částice''. Existuje vůbec něco jako nejmenší částice? Nebude přece vždy možné věci dělit na dvě poloviny, i když možná jen teoreticky? Řecký filozof Démokritos (460-371 př. n. l.) s takovou myšlenkou nesouhlasil. Démokritos předpokládal existenci nejmenších dále nedělitelných částic: atomů (z řeckého atomos = nedělitelný).
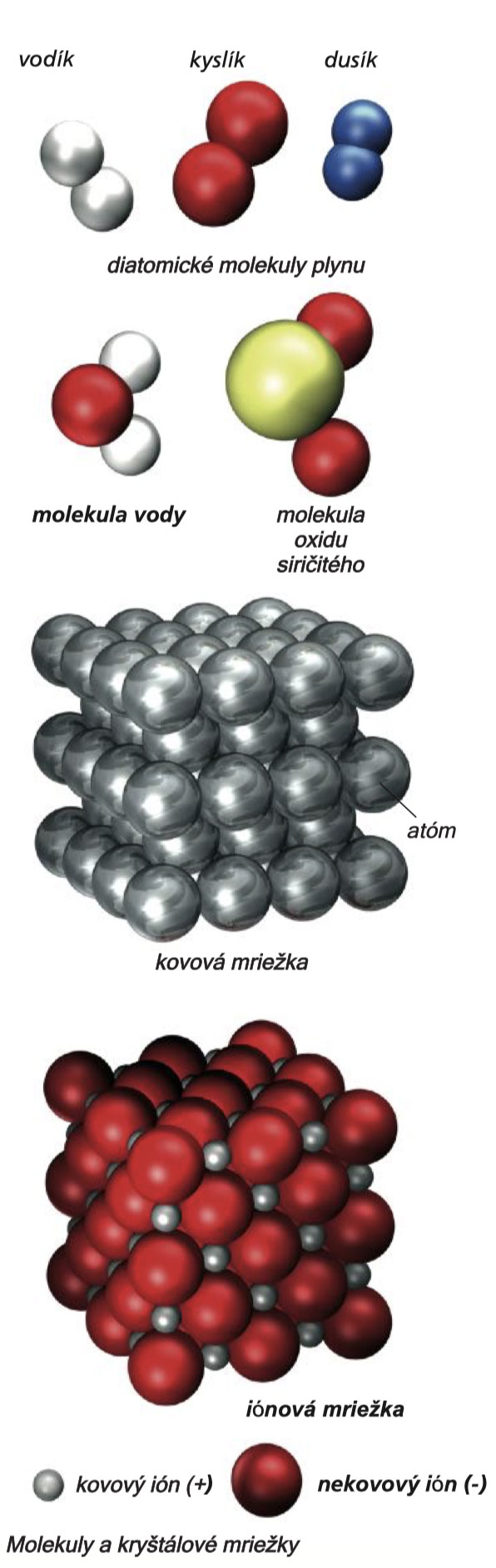
Do oblasti chemie atomy vstoupily díky Johnu Daltonovi (1766-1844). Dalton na základě experimentálních výsledků a dat usoudil, že je každý chemický prvek tvořen identickými atomy, zatímco atomy různých prvků se navzájem liší. Tak jako kdysi Dalton i my si nyní můžeme atomy představit jako drobné kuličky uspořádané různými způsoby tak, jak můžete vidět na obrázku vlevo.
Atomy se spojují s jinými atomy téhož druhu - atomy většiny plynů se vyskytují v párech - ať s prvky, nebo molekulami jiných prvků. Takovým způsobem vzniknou jednotlivé molekuly (z latinského molecula = malá hmotnost) nebo krystalové mřížky sestávající z tisíců a tisíců atomů a molekul seřazených do řad. Kovové mřížky obsahují téměř výlučně atomy identického prvku kovu, zatímco iontové mřížky jsou tvořeny kladně a záporně nabitými atomy, nazývanými ionty, o kterých se brzy dozvíte něco víc. Jedním z nespočetného množství materiálů tvořených molekulovými mřížkami je cukr.
Jak velké (či malé) jsou atomy? Nepředstavitelně malé! Jeden centimetr krychlový (cm3) plynu obsahuje 269 trilionů molekul, které v něm neustále víří a točí se. To znamená číslo 269 následované osmnácti nulami! Ani nejvýkonnější elektronový mikroskop není dostatečně výkonný k tomu, aby zviditelnil atomy. Jediný dosud známý způsob, který nám dokáže pomoci s odhalováním struktury a složení atomů, je zprostředkován nedávným vynálezem nazvaným skenovací tunelový mikroskop. Vědci však byli o existenci atomů přesvědčeni už delší dobu, protože tato idea pomohla vysvětlit mnohé fyzikální a chemické procesy.
To však není vše. Už jste možná slyšeli o tom, že atomy vůbec nejsou nedělitelné. Naopak, sestávají z ještě menších částic, nazývaných elementární částice. Ty však představují kapitolu a rozsáhlé téma samy o sobě a prozatím se jimi nemusíte trápit.
Tajemství chemických vzorců
Je nezbytné, abyste znali a pamatovali si značky jednotlivých chemických prvků z tabulky na straně 23. Pro chemiky tyto značky představují více než jen zkratky. Symbol H by přečetli jako ,,1 atom vodíku'', symbol O zase jako ,,1 atom kyslíku''. V případě molekul plynů vodíku či kyslíku tvořených 2 atomy daného prvku by chemici napsali H2 či O2. Dolní indexy naznačují, že se daný atom vyskytuje v molekule více než jedenkrát (v uvedených příkladech dvakrát).
V případě, že byste chtěli zapsat vzorec odpovídající chemické sloučenině, shromáždili byste na hromádku značky jednotlivých prvků obsažených ve sloučenině jeden po druhém. Molekula vodíku sestává ze 2 atomů vodíku (H) a 1 atomu kyslíku (O). Vzorec vody proto nakonec zní HHO - ovšem vzhledem k zažitý způsob značení - H2O. Podobná pravidla platí pro molekulu oxidu siřičitého SO2, jejíž chemické značení naznačuje, že se 1 atom síry (S) spojí se 2 atomy kyslíku za vzniku oxidu siřičitého. Přípona -ičitý naznačuje, že množství daného prvku se vůči 2 jednotkám množství druhého prvku vyskytuje v molekule čtyřikrát.
Neexistuje však žádná molekula, která by odpovídala chloridu sodnému (kuchyňské soli). V řeči chemiků vzorec NaCl signalizuje fakt, že se v krystalové mřížce soli na každý nabitý atom chlóru nachází opačně nabitý atom sodíku - jinými slovy, tato sloučenina obsahuje stejný počet atomů sodíku i atomů chlóru.
Vzorce odpovídající jednotlivým chemikáliím můžete dokonce použít i k zápisu jednotlivých probíhajících chemických reakcí jednoduchým, přehledným a jasným způsobem:
S + O2 → SO2
2mg + O2 → 2MgO
Na levé straně šipky se nacházejí reakční počáteční materiály a na pravé straně za šipkou vidíte produkty reakcí. Celkový zápis nazýváme reakčním schématem. Berte však na vědomí, že tento zápis nepředstavuje skutečnou reakci.
Jednotlivé počty atomů určitého typu se musí na levé a pravé straně šipky shodovat.
Vodík
Vodík (lat. Hydrogenium) je chemický prvek v periodické tabulce prvků, který má značku H a atomové číslo 1. Je to nejjednodušší chemický prvek, hořlavý, bezbarvý plyn bez chuti a zápachu. Je to nejlehčí plyn vůbec (14,5krát lehčí než vzduch). Ve volné přírodě se atomy vodíku nevyskytují, atomový vodík se u svého zrodu okamžitě spojuje do molekuly H2. Vodík objevil Henry Cavendish v roce 1766.
Pro více informací klikněte sem.